| PROFUNDIZACIÓN SOBRE LOS SILICATOS |
|---|
| Estructura básica → tetraedro del ión sílice, SiO44-, constituidos por 4 átomos de O2- que se encuentran en los vértices, rodeando al catión Si4+, que ocupa el centro geométrico del tetraedro. La unión entre el Si y los O es covalente, y por tanto, muy fuerte. |  |
Quedan 4 cargas - de los O sin neutralizar, por lo que éstos podrán unirse en enlace iónico con diversos cationes (Fe2+, Mg2+, K+, Na+, Al3+, Ca2+) o bien con otros tetraedros, por los vértices, en enlace covalente.
| Si el radio iónico es parecido, un catión puede ser sustituido por otro. • Sustitución simple: Fe2+ y Mg2+. Ej.: olivino, (Mg, Fe)2SiO4. El Fe y Mg se mezclan en cualquier proporción entre los extremos Fe2SO4 (forsterita) y Mg2SO4 (fayalita). • Sustitución doble: Ca2+ y Na+. Sobra una valencia +, la cual es neutralizada por la sustitución simultánea del Si4+ por el Al3+. Ej.: La serie de las plagiclasas, entre los extremos anortita, CaAl2Si2O8, y albita, NaAlSi2O8. |
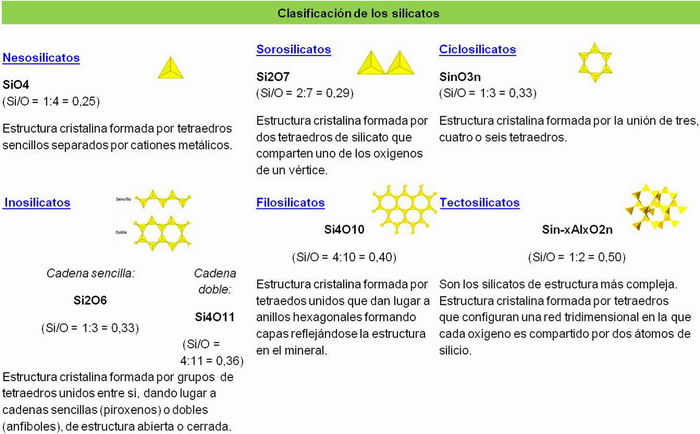 |
♦ Nesolicatos (silicatos-isla o tetraedros-isla)
Los tetraedros están aislados unos de otros y sólo están unidos entre sí por cationes:
- Por 1 catión tetravalente. Ej.: circón, ZrSiO4, o bien:
- Por 2 cationes divalentes. Ej.: Mg2+ y Fe2+ → dan lugar a la forsterita, Fe2SO4,y a la fayalita, Mg2SO4, que son los extremos de la serie isomorfa de los olivinos = peridotos, (Mg, Fe)2SiO4.
♦Sorosilicatos (tetraedros-pareja)
Los tetraedros están unidos dos a dos, compartiendo un O. Cada pareja se une a otra por cationes. Son muy raros.
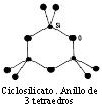 |
♦ Ciclosilicatos (tetraedros-anillo) Los tetraedros forman anillos (cerrados y planos de 3, 4 ó 6 unidades) que comparten 2 átomos de O. Son escasos, aunque algunos dan gemas. |
♦ Inosilicatos (tetraedros-cadena)
Los tetraedros se disponen en cadenas (→ aspecto fibroso), uniéndose éstas entre sí por cationes. Abundan en las rocas ígneas, sobre todo en las pobles en SiO2.
Las cadenas pueden ser:
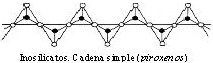
- Simples → cada tetraedro está unido sucesivamente a sus vecinos por 2 oxígenos. Ej.: piroxenos.
 |
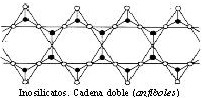 |
- Dobles → dos cadenas simples unidas: cada tetraedro comparte alternativamente 2 y 3 oxígenos. Ej.: anfíboles.
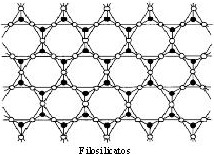
♦ Filosilicatos (tetraedros-hoja)
Los tetraedros se disponen en planos. Cada tetraedro se une a sus vecinos compartiendo 3 oxígenos, estando situados todos los oxígenos compartidos en un plano.
| El único oxígeno sin saturar por tetraedro se une a otras hojas por intermedio de diversos cationes. Son fácilmente exfoliables. A veces se sustituye el Si4+ por el Al3+ → silicatos alumínicos (aluminosilicatos). Ej.: micas [moscovita (K) (aluminosilicato félsico), biotita (Fe, Mg) (aluminosilicato máfico)], talco (silicato de Mg hidratado), cloritas, serpentina, caolín (silicato de Al hidratado),... |
 |
♦ Tectosilicatos (tetraedros-armazón)
Tetraedros con armazón tridimensional. Todos los tetraedros comparten sus 4 oxígenos, sin que haya valencias libres → su gran dureza. Los tectosilicatos son los silicatos más abundantes en todo tipo de rocas, sobre todo en las ígneas.
La condición de compartir los cuatro O sólo es cumplida por el cuarzo (muy duro e inalterable a la erosión). En el resto de los tectosilicatos, cada cuatro tetraedros hay uno en el que el Si4+ es sustituido por el Al3+, lo que hace que existan cargas - que permiten la unión con cationes (Ca, Na, K,...).
Ej.: feldespatos (tectosilicatos alumnínico-potásicos con Na y Ca). Algunos de los Si4+ son sustituidos por Al3+, formando unidades del tipo AlSi3O8-; las valencias libres se saturan con cationes de Ca, Na o K, dando lugar a diferentes feldespatos.:
- Ortosa, K(AlSi3O8)
- Serie isomorfa de las plagioclasas: albita, Na(AlSi3O8), ... , anortita, Ca(Al2Si2O8).