| EJERCICIOS DE REACCIONES Y ESTEQUIOMETRÍA |
|---|
1. Hallar el nº de moll. que existen en 500 de de CaI2.
RTA.:
Masa de 1 mol de CaI2: 40 + 2 · 127 = 294 g.
Hallemos los moles que hay en 500 g de CaI2: 500 g / 294 (g/mol) = 1,7 moles de CaI2.
Moll. que hay en 1,7 moles = 1,7 · NA = 1,7 · 6,023·1023 = 10,23·1023 moll. de CaI2.
2. Tenemos 20 de cada una de las siguientes sustancias: KCl y Mg(NO3)2.
a) ¿En cuál de ellas hay más moles?
b) ¿En cuál de las dos habrá más moléculas?
RTA.:
a) 1 mol de KCl = 39,1+35,5 = 74,6 g. 1 mol de Mg(NO3)2 = 24,3+2·14+6·16 = 148,3 g.
Nº de moles de KCl = 20 / 74,6 = 0,26 moles.
Nº de moles de Mg(NO3)2 = 20 / 148,3 = 0,13 moles.
b) Hay más moll. en el KCl (que es donde hay más moles).
3. Para realizar una determinada reacción química necesitamos 2 moles de Fe2O3. Calcular la masa en g que debemos utilizar.
RTA.:
Pm=160; m=2·160 = 320 g.
4. En 50 g de agua, ¿cuántos moles hay? ¿Y cuántas moléculas?
RTA.:
2,78 moles; 16,72 ·1023 moléculas.
5. ¿A cuántos g equivalen 0,25 moles de Na2CO3?
RTA.:
0,25 ·106 = 26,5 g.
6. Calcula el V, medido en c.n., de ocupan 3 moles de SO2.
RTA.:
22,4 · 3 = 67,2 L.
7. ¿Qué V ocuparán 2,5 moles de H medidos a 0 C y 1 atm. de P?
RTA.:
2,5 moles · 22,4 L/mol = 56 L.
8. En c.n., la masa de un gas es de 2,8 g y ocupa un V de 2,24 litros. Calcula la masa molar del gas.
RTA.:
28 g/mol.
9. Calcular el V que ocupan 2 g de CO2, en c.n. de P y T.
RTA.:
Tenemos 0,045 moles → V = 0,045 moles · 22,4 L/mol = 1 L.
10. ¿Qué masa corresponde a cierto V de N2 que ocupan 30 litros en c.n.?
RTA.:
n=30/22,4=1,34 moles de N2 → 1,34 · 28 = 37,52 g.
11. ¿Cuántas moléculas de Cl hay en 177,5 g de este gas? ¿Y que volumen ocupan?
Indicación: la molécula de Cl es diatómica.
RTA.:
N º de moles de Cl2=177,5/71 = 2,5 moles.
a) Nº de moléculas de Cl2 = 2,5 · 6,023 · 1023 = 15,0575 · 1023 = 1,50575 · 1024 moléculas.
b) V=2,5 · 22,4 = 56 L.
12. Hacemos que se combinen un litro de N con dos litros de O, medidos ambos en las mismas condiciones de P y T. En el proceso se obtienen 2 L de un óxido de nitrógeno, medidos en las mismas condiciones. ¿Cuál será la fórmula química del óxido de nitrógeno obtenido?
RTA.:
Según la ley de Avogadro, en un mismo volumen hay el mismo número de moléculas, en las mismas condiciones de presión y temperatura. Considerando que en un volumen hay una molécula:
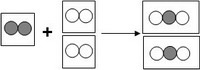 |
| N2 + 2O2 → 2NO2 |
13. Tenemos 10 moles de H2SO4. Contesta a las siguientes cuestiones:
a) ¿cuántas moles de moléculas hay?; b) ¿cuántos moles de átomos de hidrógeno hay?; c) ¿cuántos gramos de azufre hay?
RTA.:
a) Hay 10 moles de moléculas.
b) Como en un mol de moléculas de H2SO4 hay dos moles de átomos de H, en diez moles de moléculas hay 20 moles de átomos de H.
c) 10 moles de H2SO4 tienen una masa de 10·98 = 980 g. Si en 98 g de H2SO4 hay 32 g de S, en 980 g de H2SO4 habrá X g de S. X = 320 g. de S
14.Calcula la E que se desprende al quemar un kg de C, sabiendo que la combustión de un mol de C produce 410 kJ.
RTA.:
nº de moles de C = (g de C) / 12 = 1000/12 = 83,33 moles. La E desprendida será: 83,33 · 410 = 34.165 kJ.
15. Escribir las reacciones químicas correspondientes a las sig. reacciones, ajustarlas y clasificarlas.
a) Reacciones de ...
Zn + O2 → ZnO
Cu + O2 → CuO
Mg + O2 → MgO
CH4 + O2 → CO2 + H2O + 890 kJ
b) Reacciones de ...
Fe + S → FeS
P + O2 → P2O5
N2 + H2 → NH3
S + O2 → SO2
SO2 + O2 → SO3
CO2 + H2O → C6H12O6 + O2
c) Reacciones de ...
H2O → H2 + O2
H2O2 → H2O + O2
KClO3 → KCl + O2
(NH4)2CO3 + Q → NH3 + CO2 + H2O
CaCO3 + Q → CaO + CO2
d) Reacciones de ...
C + CuO → CO2 + Cu
CuSO4 + Fe → FeSO4 + Cu
AgNO3 + Cu → Cu(NO3)2 + Ag + Q
KI + Pb(NO3)2 → KNO3 + PbI2
e) Reacciones de ...
SFe + HCl → SH2 + Cl2Fe
Pb(NO3)2 + NaI → PbI2 + NaNO3
AgNO3 + NaCl → AgCl + NaNO3
RESPUESTAS:
a) Reacciones de oxidación:
2Zn + O2 → 2ZnO
2Cu + O2 → 2CuO
2Mg + O2 → 2MgO
CH4 + 2O2 → CO2 + 2H2O + 890 kJ (exotérmica)
b) Reacciones de síntesis o composición:
Fe + S → FeS
4P + 5O2 → 2P2O5
N2 + 3H2 → 2NH3
S + O2 → SO2
2SO2 + O2 → 2SO3
6CO2 + 6H2O → C6H12O6 + 6O2 (síntesis de la glucosa)
c) Reacciones de descomposición:
2H2O → 2H2 + O2
2H2O2 → 2H2O + O2 (descomposición del agua oxigenada)
2KClO3 → 2KCl + 3O2
(NH4)2CO3 + Q → 2NH3 + CO2 + H2O (endotérmica)
CaCO3 + Q → CaO + CO2 (endotérmica)
d) Reacciones de sustitución:
C + 2CuO → CO2 + 2Cu
CuSO4 + Fe → FeSO4 + Cu
2AgNO3 + Cu → Cu(NO3)2 + 2Ag + Q (exotérmica)
2KI + Pb(NO3)2 → 2KNO3 + PbI2
e) Reacciones de doble sustitución:
SFe + 2 HCl → SH2 + Cl2Fe
Pb(NO3)2 + 2 NaI → PbI2 + 2 NaNO3
AgNO3 + NaCl → AgCl + NaNO3
16. El Zn reacciona con el HCl, formándose cloruro de Zn e H.
a) Calcula la molaridad que corresponde a la disolución de HCl, si 800 ml de dicha disolución reaccionan con 1,5 moles de Zn.
b) ¿Cuántos gramos obtenemos de ZnCl2?
c) ¿Cuantoso litros obtenemos de H2?
RTA.:
Reacción ajustada: Zn + 2HCl → ZnCl2 + H2
a) (1 mol de Zn) / (2 moles de HCl) = 1,5 / x → x = 3 moles de HCl → M = 3 / 0,8 = 3,75 M.
b) 1,5 moles de Zn → 1,5 moles de ZnCl2 → 1,5 · 136,36 = 204,54 g.
c) 1,5 moles de Zn → 1,5 moles de H2 → 1,5 · 22,4 = 33,6 L.
17. Calcular el V de una disolución de ácido sulfúrico 2 M que se necesita para reaccionar completam. con 10 g de óxido de Cu (II). En la reacción obtenemos sulfato de Cu y agua.
RTA.:
Reacción ajustada: CuO + H2SO4 → CuSO4 + H2O.
Masa molar de CuO = 80 g → 10 g equivalen a 10/80 moles de CuO.
Relación que nos interesa entre datos e incógnitas: (1 mol de CuO) / (1 mol de H2SO4) = 0,125 / x → x = 0,125 moles de H2SO4.
Es decir, son nec. 0,125 moles de H2SO4 para reaccionar completam. con 10 g de CuO.
Vamos a expresar el resultado en V: M = 2 = 0,125 / V → V = 0,0625 litros = 62,5 ml.
18. Un volumen (molar) de O se combina con un volumen de N, y se obtienen dos volúmenes de una sust. gaseosa llamada monóxido de N. ¿Cuál es la fórmula de dicha sustancia? Escribir la reacción química ajustada.
RTA.:
O2 + N2 → 2NO (hay que tener en cuenta que los gases tienen moll. diatómica).
19. Un compuesto gaseoso tiene de fórmula N2O4. Indica la proporción en que reaccionaron los volúmenes de N y O para formar dicho compuesto.
RTA.:
2O2 + N2 → N2O4, es decir, 1 volumen de N y 2 volúmenes de O.
20. Un volumen de N se combina con tres volúmenes de H (ambos gases), y se obtienen dos volúmenes de una sustancia gaseosa llamada amoníaco. Deducir la fórmula del amoniaco.
RTA:
N2 + 3H2 → 2NH3
21. Una gota de Hg, de 7 g de masa, se hace reaccionar con Br líquido (molécula biatómica). Cuando finaliza la reacción se obtienen 12,6 g de una sustancia sólida blanca llamada bromuro de Hg. ¿Cuántos gramos de Br intervienen en la transformación química?
RTA.:
Hg + Br2 → HgBr2
7g + x = 12 g → x = 12-7 = 5 g de Br2 (aplicando la ley de conservación de la masa).
22. En una disolución de cloruro de Hg, que es una sustancia corrosiva, se sumerge una moneda de Cu, produciéndose una reacción de sustitución. ¿Cuántos g de Hg obtenemos si en la reacción se consumen 127 g de Cu?
RTA.:
Reacción ajustada: HgCl2 + Cu → CuCl2 + Hg
La relación molar entre el Cu y el Hg es 1:1 → 127/63,5 = 2 moles de Cu me dan 2 moles de Hg → 401,2 g.
23. Calcula la masa de metano, CH4 , que se necesita para producir, mediante su combustión, 10.000 kJ de energía.
Datos: La E que se desprende al quemar un mol de metano es igual a 892 kJ. En la reacción se desprenden dióxido de carbono y agua.
RTA.:
Reacción de combustión: CH4 + O2 → CO2 + 2H2O.
Moles de CH4 que han de quemarse: 10.000/892 = 11,21 moles → 11,21 · 16 = 179,36 g de CH4.
24. ¿Qué cantidad de E se libera durante la combustión del metano, CH4, si se utilizan para ello 100 g de oxígeno?
Datos: La E que se desprende al quemar un mol de metano es igual a 892 kJ. En la reacción se desprenden dióxido de carbono y agua.
RTA.:
Reacción de combustión: CH4 + O2 → CO2 + 2H2O.
Moles de O2: 100/32 = 3,125 moles → 3,125 moles de CH4 → 3,125 · 892 = 1.393,75 kJ de E.
25. Calcula la E que produce la combustión de 2 kg de S. En la reacción se forman dióxido de S.
Dato: cuando se quema un mol de S se liberan 297 kJ.
RTA.:
Reacción química ajustada: S + O2 → SO2 .
Moles de S: 2000/32 = 62,5 moles → 62,5 · 297 = 18.562,5 kJ de E.
26. El S reacciona con el Al formándose sulfuro de dialuminio. ¿Cuántos moles de átomos de Al y cuántos moles de átomos de S debemos tomar para que reaccionen totalm. entre sí?
RTA.:
Reacción química ajustada: 3S + 2Al → Al2S3 → 3 de S y 2 de Al.
27. Calcula la masa de CaSO4 que puede obtenerse a partir de 20 g de CaO, si la ec. que corresponde a la reacción es: CaO + H2SO4 → CaSO4 + H2O.
RTA.: 48,9 g.
28. ¿Qué concentración molar tendrá una disolución de ácido sulfúrico, si 100 cm3 de la misma han reaccionado con 50 cm3 de una disolución de hidróxico sódico de concentración 1 M? En la reacción se forman sulfato sódico y agua.
RTA.:
Reacción ajustada: H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
Cálculo del nº de moles de NaOH → 1= n / 0,05 → n = 0,05 moles.
Cálculo del nº de moles de H2SO4 → 2 moles NaOH / 1 mol de H2SO4 = 0,05 / x → n = 0,025 moles de H2SO4.
Cálculo de la concentración molar del H2SO4 → M = 0,025 / 0,1 = 0,25 M.
29. ¿Qué masa de Ag se obtendrá si se hacen reaccionar 50 g de nitrato de Ag con Fe? En la reacción se forma tb. nitrato de Fe (II).
RTA.:
Reacción ajustada: 2 AgNO3 + Fe → Fe(NO3)2 + 2 Ag
Cálculo del nº de moles de AgNO3 → n = 50 / 170 = 0,29 moles.
Cálculo del nº de moles de Ag formado → 2/2 = 0,29/n → n = 0,29 moles de Ag.
Cálculo de la masa de Ag → m = 0,29 · 108 = 31,32 g de Ag.
30. ¿Qué concentración molar tendrá una disolución de hidróxido de K, si 100 mL de la misma han reaccionado con 200 mL de ácido nítrico de concentración 0,5 molar? En la reacción se forman nitrato de K y agua.
RTA.:
Reacción ajustada: KOH + HNO3 → KNO3 + H2O.
Nº de moles de HNO3 que han reaccionado → 0,5 = n/0,2 → n= 0,1 moles de HNO3.
Cálculo del nº de moles de NaOH que se han necesitado → 1/1 = n/0,1 → n= 0,1 moles de KOH.
Cálculo de la concentración molar del KOH → M= 0,1/0,1 = 1 M.
31. Si tuvieras que disolver completamente unos clavos de Fe que pesan 2 g, y dispones en el lab. de un frasco de HCl al 20 % de masa, ¿qué masa del mismo debes poner en el frasco de precipitados en el que has colocado los clavos? En la reacción se forman clururo de Fe (II) y se desprende H.
RTA.:
Reacción ajustada: Fe + 2HCl → FeCl2 + H2.
Moles de Fe → 2/55,85 = 0,035 moles.
Cálculo del nº de moles de HCl que necesitamos → 1/2 = 0,035/n → n= 0,07 moles de HCl.
Cálculo de la masa de HCl → m= 0,07 · 36,5 = 2,56 g de HCl.
Cálculo de la masa de disolución, al 20 %, que necesitamos → 0,20 = 2,56/x → x= 12,6 g.
32. ¿Cuál es la masa de Al que reaccionará completam. con H2SO4 para obtener 10 litros de H medidos a 20 ºC y 3 atm de P?
Reacción química: Al + H2SO4 → Al2 (SO4)3 + H2O.
RTA.:
Reacción química ajustada: 2Al + 3H2SO4 → Al2 (SO4)3 + 3H2.
Calculemos los 10 Litros en c.n.: PV/T=P´V´/T´ → 1·V/273 = 3·10/293 → V=55,9 L.
Cálculo de moles de H: n=55,9/22,4 = 2,5 moles.
Como la relación molar entre el Al y el H es 2 a 3, hacemos una proporción para hallar los moles que reaccionan de Al:
2/3=n/2,5 → nAl=1,67 moles de Al → nAl=1,67 · 27 = 45 g.
22,4 g.
33. ¿Qué masa de P debe quemarse para obtener 7,1 g de P2O5?
RTA.:
Reacción química ajustada: 4P + 5O2 → 2P2O5.
3,1 g.
34. Para realizar una soldadura se utiliza un soplete de acetileno, C2H2. Durante la misma se consumen 11,2 litros de O, medidos en c.n. ¿Cuántos litros de acetileno, medidos tb. en c.n., se han consumido.
RTA.:
Reacción química ajustada: 2C2H2 + 5O2 → 4CO2 + 2H2O.
4,48 g.
35. ¿Cuántos g de Cl son necesarios para reaccionar completam. con 12 g de H, si en la reacción se obtiene HCl? ¿Cuánto HCl se obtiene?
RTA.:
Reacción química ajustada: Cl2 + H2 → 2HCl.
426 g. 438 g.
36. El amoniaco (gas), NH3, reacciona con el cloruro de H (gas) para formar un sólido de color blanco, el cloruro de amonio, NH4Cl. Escribe la reacción ajustada y calcula la masa de HCl que reaccionará con 10 g de NH3.
RTA.:
Reacción química ajustada: NH3 + HCl → NH4Cl.
21,47 g.
37. Calcula los g de KCl que se obtienen al descomponer 100 g de KClO3.
RTA.:
Reacción química ajustada: 2KClO3 → 2KCl + 3O2.
N º de moles de KClO2 = 100/122,5 = 0,82. Moles de KCl = 0,82. Masa de KCl obtenida = 0,82 · 74,5 = 61,1 g.
38. Calcular el V de CO2 que se obtiene al calentar 25 g de CaCO3 a 125 ºC y 770 mm de Hg.
RTA.:
Reacción química ajustada: CaCO3 → CaO + CO2.
25/100 = 0,25 moles de CaCO3. 0,25 moles de CO2.
Aplicamos la ec. de los gases perfectos: P·V = nRT. P=770/760 atm, T=125+273 = 398 ºK. V=8,05 L.
39. ¿Qué cantidad de O2 es necesaria para obtener 150 g de dióxido de S en la combustión del S?
RTA.:
Reacción química ajustada: S + O2 → SO2.
75 g de O2.
40. ¿Qué nº de moles y qué masa en g de sulfuro de Fe (II) se obtienen a partir de 20 moles de átomos de Fe y cierta cantidad de S?
RTA.:
Reacción química ajustada: Fe + S → FeS.
Tenemos 20 moles de FeS → 1756 g de FeS.
41. En la combustión del C se produce CO2, en presencia de oxígeno. Se pide:
a) Escribir la reacción.
b) Calcular la cantidad de CO2 que se obtiene a partir de 100 g de C.
c) ¿Qué cantidad de oxígeno se consume, según los datos anteriores?
d) ¿Qué cantidad de CO2 se obtiene si se quema 1 kg de carbón, con un contenido en C puro del 80 %?
RTA.:
a) C + O2 → CO2
b) 100 g de C son 8,33 moles. Por tanto, m=6,33 · 44 = 366,52 g de CO2.
c) m = 8,33 · 32 = 266,56 g de O2.
d) 80% de 1000 g = 800 g de C puro, que son 66,67 moles. Se obtienen entonces 2933,48 g de CO2, o sea, 2,933 kg.
42. Calcula la molaridad de una disolución de NaOH, sabiendo que 200 ml de dicha disolución reaccionan exactam. con 20 g de CO2, de acuerdo con la reacción química sig. (que no está ajustada):
NaOH + CO2 → Na2CO3 + H2O
RTA.:
Reacción ajustada: 2 NaOH + CO2 → Na2CO3 + H2O
4,33 M.
43. El sodio reacciona con el agua, dándonos hidróxido sódico e hidrógeno libre. Después de escribir y ajustar la reacción química, se pide:
(a) ¿Cuántos gramos de hidróxido de sodio se forman a partir de 46 g de sodio?
(b) ¿Qué volumen de hidrógeno se recoge en condiciones normales?
RTA.:
Reacción química ajustada: 2Na + 2H2O → 2NaOH + H2
(a) Con 2 moles de Na se obtienen 2 moles de NaOH.
Con 2·23 g de Na se obtienen 2.40 g de NaOH.
Con 46 g de Na se obtendrán m g. de NaOH → m=80 g de NaOH.
(b) Con 2 moles de Na se obtiene 1 mol de H2. Con 2·23 g de Na se obtienen 22'4 L de H2.
Con 46 g de Na se obtendrán V L de H2 → V = 22´4 L de H2.
44. El ácido sulfúrico reacciona con el carbonato de magnesio, formando sulfato de magnesio, dióxido de carbono y agua. Después de escribir y ajustar la reacción química, se pide:
(a) Determinar los gramos de ácido que se necesita para reaccionar con 4 kg de carbonato de magnesio.
(b) ¿Qué volumen de CO2 medido en condiciones normales se obtiene?
RTA.:
Reacción ajustada: H2SO4 + MgCO3 → MgSO4 + CO2 + H2O
(a) Con 1 mol de MgCO3 reacciona 1 mol de H2SO4. Con 84,3 g de MgCO3 reaccionan 98 g de H2SO4.
Con 4000 g de MgCO3 reaccionarán m g de H2SO4 → m = 4650,06 g de H2SO4.
(b) Con 1 mol de MgCO3 se obtiene 1 mol de CO2.
Con 84,3 g de MgCO3 se obtienen 22,4 L de CO2. Con 4000 g de MgCO3 se obtendrán V L de CO2 → V = 1062,87 L de CO2.