| REACCIONES QUÍMICAS. ESTEQUIOMETRÍA |
|---|
| CANTIDAD DE MATERIA. EL MOL |
La unidad de cantidad de materia en el S.I. se llama mol.
Un mol (molécula-gramo) de una sustancia pura → es su masa molecular expresada en g.
En un mol de una sust. pura cualquiera hay el mismo nº de moléculas = 6,023·1023 moll.= número de Avogrado, NA. O, lo que es lo mismo, 6,023·1023 moll. de una sustancia pura cualquiera tienen una masa, en g, igual al valor masa molecular (que es la masa de su mol). En resumen: un mol de una sustancia es la cantidad de materia que hay en el NA de part. de la misma.
Igualm., átomo-gramo de un elem. químico es su masa atómica expresada en g, y equivale a 6,023·1023 átomos de dicho elem.
En gen., un mol es la masa, expresada en g, del cj. formado por 6,023·1023 part. idénticas.
| Probemos lo anterior con un mol de H2O, que tiene un Pm = 18 → el mol de agua son 18 g. Una molécula-gramo de H2O tiene una masa de 18 g. ¿Cuántas moll. contiene? Habrá que dividir los 18 g entre la masa de una moll. de agua. La masa molecular del agua es 18 uma y 1 uma = 1,66 · 10-24 g, o sea, que una moll. de agua tiene una masa de 18 · 1,66 · 10-24 g. Por lo tanto, las moll. que hay en los 18 g de agua serán: N = 18 g / (18 umas · 1,66 · 10-24 g) = 1 g / 1,66 · 10-24 g = 6,023·1023 moléculas de H2O |
Cálculos con gases
Para una misma P, el V de los gases está relacionado con su nº de moles, y es independiente del tipo de gas. A 0 ºC y a 1 atm de P, cualquiera que sea el gas, el mismo nº de moles implica el mismo V.
Un mol de un gas a la T de 0 ºC y a 1 atm. de P, ocupa un V = 22,4 L.
Ejemplos probatorios:
1. Probar que átomo-gramo del Na tiene una masa de 23 g.
RTA.:
Masa atómica del Na = 23 uma. Masa de 1 uam. = 1,66 · 10-24 g.
Átomo-gramo de Na = 23 · 6,023 ·1023 uma = 23 · 6,023 · 1023 ·1,66 · 1010-24 g = 23 g.
2. Probar que la molécula-gramo = mol del agua tiene una masa de 18 g.
RTA.:
Masa molecular del agua = 18 uma. Masa de 1 uam = 1,66 · 10-24 g.
Mol de agua = 18 · 6,023 ·1023 uma. = 18 · 6,023 ·1023 ·1,66 ·10-24 g = 18 g.
| REACCIONES QUÍMICAS |
Reacción química → transformación de la materia donde los átomos de las sust. que intervienen (reactivos) se reorganizan dando lugar a moll. de dif. nat. (productos).
Una reacción química se expresa por medio de una ecuación química donde se reflejan las fórmulas de las sust. que intervienen y de las resultantes: CaO + CO2 → CaCO3.
 |
Las sust. reaccionantes se transforman en los productos de la reacción no directam., sino pasando por una estructura transitoria intermedia, de alto contendido energético → complejo activado. Para que las moléculas reaccionantes alcancen el estado de complejo activado, hay que suministrarles la denominada energía de activación.
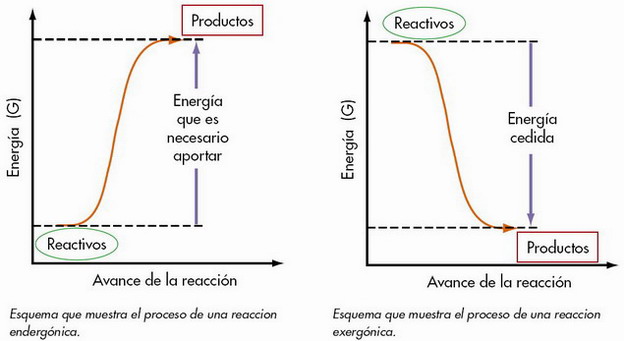 |
En una reacción química siempre se produce un cambio energético en el sistema, con desprendimiento o absorción de E.
Si E2< E1 → reacción exotérmica.
Si E2> E1 → reacción endotérmica.
Ej.:
Na + H2O → NaOH + H2 + Q (exotérmica)
2HgO + 181 kJ → 2Hg + O2 (endotérmica)
Las reacciones pueden ser:
- Reversibles: A + B ↔ C + D
- Irreversibles: A + B → C + D
Ej.:
2H2 + O2 ↔ 2H2O (hacia la dcha. es de síntesis, y hacia la izda., de descomposición).
Velocidad de reacción → cantidad de reactivo (o producto) transformado en cada unidad de t.
Factores que influyen en la velocidad de reacción:
- La naturaleza y el estado físico de las sust. reaccionantes.
- La T y la P.
- La concentración.
- Los catalizadores.
| CONSERVACIÓN DE LA MASA EN LAS REACCIONES QUÍMICAS AJUSTE DE REACCIONES |
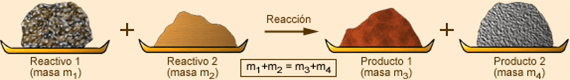
En toda reacción química, la masa de los reactivos es igual a la masa de los productos, es decir, se conserva la masa del sistema. Como consecuencia, tiene que haber el mismo nº de átomos en reactivos que en productos, ya que el nº de átomos que intervienen no se modifica, sólo se produce una reagrupación de los mismos.
 |
Ejemplos:
1. Si se hace reaccionar Fe con O, y se obtiene óxido de Fe (II). Si se pesan 56 g de Fe y se obtienen 72 g de óxido de Fe (II), ¿qué cantidad de O ha reaccionado?
RTA.:
Como el nº de átomos de cada elem. en cada miembro de la ec. química debe ser el mismo, es nec. ajustar la reacción:
Fe + O2 → Fe2O3 → 4Fe + 3O2 → 2Fe2O3.
72-56 = 16 g de O2.
2. Al calentar el magnesio, reacciona con el oxígeno del aire, formando óxido de magnesio. Si se calientan 0'76 g de magnesio, se forman 1'26 g del óxido. ¿Cuántos gramos de oxígeno han reaccionado?
RTA.:
Mg + O2 → MgO.
m Mg = 0,76 g; m MgO = 1,26 g. La dif. será la masa de O2 que ha reaccionado con el Mg: m = 1,26 - 0,76 = 0,5 g de O2.
Una ec. química permite establecer una proporción, bien en moléculas, bien en moles, entre todas las sustancias que intervienen.
Lo mismo da decir:
- 4 moléculas de Fe reaccionan con 3 moléculas de O, dándonos 2 moléculas de óxido férrico, que decir:
- 4 moles de Fe reaccionan con 3 moles de O, dándonos 2 moles de óxido férrico.
Ejemplos de ajuste de reacciones:
1. Ajustar la reacción: Al + Cl2 → AlCl3
RTA.:
aAl + bCl2 → cAlCl3.
Para el Al: a = c
Para el Cl: 2b = 3c.
Damos un valor arbitrario a una de las incógnitas: por ej.: a = 1. Entonces, c = 1, y b = 3/2. Multiplicamos a todo por 2 para quitar los denominadores, quedando: a=2, b=3, c=2 → 2Al + 3Cl2 → 2AlCl3.
2. Ajustar la reacción: C2H2 + O2 → CO2 + H2O
RTA.:
aC2H2 + bO2 → cCO2 + dH2O. Hacemos el contaje de cada clase de átomos:
C: 2a = c
H: 2a = 2d
O: 2b = 2c + d Haciendo a = 1, obtenemos: c=2, d=1, b =5/2 → C2H2 + 5/2 O2 → 2 CO2 + H2O
→ 2C2H2 + 5O2 → 4CO2 + 2H2O
3. En la reacción del N y el O, ¿por qué no podemos escribir N + O → NO?
RTA.:
Es N2+O2 = 2NO.
4. Ajustar:
a) HCl + NaOH → NaCl + H2O
b) Cu (s) + 4 HNO3 (aq) → Cu(NO3)2 (aq) + 2 NO2 (g) + 2 H2O (liq)
c) Zn + 2 HCl → ZnCl2 + H2 + Q (exotérmica)
5. Ajustar:
a) CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
b) C4H10 + 13/2 O2 → 4 CO2 + 5 H2O, o bien: 2 C4H10 + 13 O2 → 8CO2 + 10 H2O
| TIPOS DE REACCIONES |
• (1) De síntesis → dos o más sust. reaccionantes nos dan una sust. única más compleja.
Ej.:
C + O2 → CO2 (tb. es una reacción de combustión)
N2 + 3H2 → 2NH3
SO3 + H2O → H2SO4
• (2) De descomposición → a partir de un comp. complejo se obtienen dos o más sust. dif. más simples.
Ej.:
CuCl2 → Cl2 + Cu
MgCO3 → MgO + CO2
2HgO → 2Hg + O2
• (3) De sustitución o desplazamiento → los comp. intercambian átomos, es decir, un elem. sustituye a otro (lo desplaza) → nuevas sust.
Ej.:
Cl2 + 2KI → 2KCl + I2
CuCl2 + Zn → ZnCl2 + Cu (así se obtienen muchos metales).
2Na + 2H2O → 2NaOH + H2 (los metales alcalinos reaccionan con el H2O desplando el H de ésta; la reacción es muy brusca, liberándose mucho calor; la combustión del H2 que se desprende origina chispas).
Fe + H2SO4 → FeSO4 + H2 (muchos metales no sustituyen al H del H2O, como hacen los alcalinos, pero sí lo hacen con el H de los ácidos).
• (4) De intercambio o doble sustitución → se intercambian las posiciones de los elem. de dos comp., obteniéndose dos nuevas sust.
Ej.:
NaCl + AgNO3 → NaNO3 + AgCl
CaCO3 + 2HCl → CaCl2 + H2CO3; además, H2CO3 → CO2 + H2O.
• (5) De combustión → reacción exotérmica, donde una sust. (combustible) reacciona con el O (comburente).
Ej.:
Combustión del carbón: C + O2 → CO2.
Combustión del butano: 2C4H10 + 13O2 → 8CO2 + 10H2O.
Para iniciar estas reacciones, hay que suministrar una E de activación ("cerilla"), pero luego la reacción se automantiene.
• (6) De neutralización → una ácido reacciona con una base para dar una sal y agua (son reacciones de intercambio).
Ej.:
HCl + NaOH → NaCl + H2O
Concepto de acidez y basicidad
Ácidos → sust. que tienen las propiedades sig.:
- Sus disoluciones acuosas tienen sabor agrio, y producen escozor al atacar la piel.
- En disolución acuosa, cuando se disuelve el ácido en agua, actuando ésta como disolvente, casi todos reaccionan con los metales, desprendiendo H.
- Cuando se añaden a un carbonato, desprenden CO2 ( burbujas).
Las prop. ant. se deben a que en su moll. existe al menos un átomo de H, que, en disolución acuosa, produce un hidrogenión, H+.
| Sustancia | Ácido que contiene |
| Vinagre | Acético |
| Zumo de limón | Cítrico |
| Zumo de naranja | |
| Vitamina C | Ascórbico |
| Veneno de las hormigas | Metanoico = fórmico |
| Jugo de ortigas | |
| Aaceite de oliva / almendras | Oleico |
Bases → sust. que tienen las propiedades sig.:
- Tienen un sabor amargo, y son suaves al tacto, grasientos, produciendo quemaduras en la piel.
Las prop. ant. se deben a que en su moll. existe al menos un grupo OH, que, en disolución acuosa, produce un hidroxilo, OH-.
Una sust. es neutra si no tiene carácter ácido ni básico.
La acidez / basicidad se mide con la escala de pH del a 1 (ácido) a 14 (básico).
Ejemplos de reacciones de neutralización:
HCl+NaOH → NaCl +H2O
H2SO4 + 2NaOH → NaSO4 + 2H2O
H2SO3 + 2NaOH → NaSO3 + 2H2O
NaOH + H2CO3 → NaHCO3 +H2O
HNO3 + Al(OH)3 → Al(NO3)3 + H2O
HCl + KOH → KCl + H2O
HCl + AgOH → AgCl + H2O
HNO3 + KOH → KNO3+ H2O
HNO3 + NaOH → NaNO3 + H2O
HCl + LiOH → LiCl + H2O
HNO3 + LiOH → LiNO3 + H2O
HCl + MgOH →MgCl + H2O
HCl + AlOH → AlCl + H2O
HCl + CuOH → CuCl +H2O
H2SO4 + 2AlOH →AlSO4 + 2H2O
| ESTEQUIOMETRÍA |
Una vez que está ajustada la reacción química, se trata de averiguar las cantidades intervinientes tanto de reactivos como de productos; para ello, realizamos los llamados cálculos estequiométricos, en los que podemos seguir los sig. pasos:
1º: Ajustar la ec. química.
2º: Expresar los datos en moles.
3º: Establecer relaciones proporcionales entre datos e incógnitas.
En las relaciones entre masa-masa y masa-V, la proporcionalidad se establece entre moles, mientras que para la relación V-V, la proporcionalidad se establece directam. entre V.
4º: Operar (expresar el resultado en las unidades adecuadas).
Hacer ejercicios de reacciones químicas y estequiometría.