| EL SISTEMA PERIÓDICO |
|---|
| CLASIFICACIÓN DE LOS ELEMENTOS. LA TABLA PERIÓDICA |
| Modelos históricos de la clasificación de los elementos - Lavoisier (XVIII) → Clasificó a los elem. en metales y no metales. - Döbereiner (p. XIX)) → Estableció grupos de tres elem. → triadas. La masa atómica del elem. central era la media de las masas atómicas de los otros dos. - Mendeleiev (XIX) y Meyer (XIX) → Situaron los elem. conocidos en orden creciente de masas atómicas, colocando en la misma columna aquellos cuyas prop. eran semejantes. Construyeron así una tabla 12 filas y 9 columnas. Llegaron a dejar huecos en la tabla en previsión de que posteriorm. se descubrieran otros elem. |
Hay unos 112 elementos distintos; algunos son artificiales, ya que son inestables (Tc, Pu). Para representar a los átomos y elementos se utilizan símbolos.
Los científicos agrupan los elementos en familias, buscando propiedades comunes varios de ellos. Se observó que las prop. de los elem. se repiten periódicamente. Esta periodicidad de las prop. se debe a la estructura electrónica de los átomos, en particular, a los e- de la última capa.
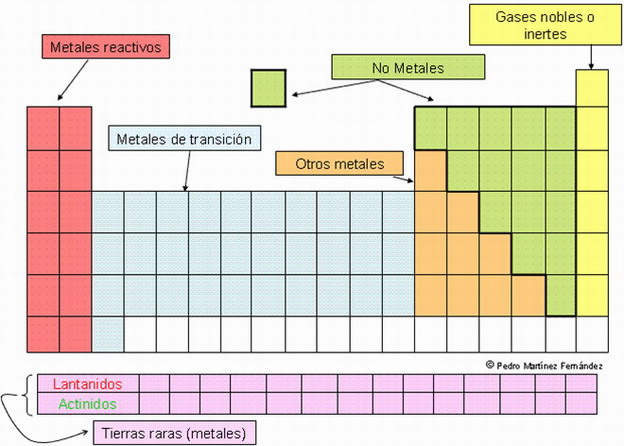 |
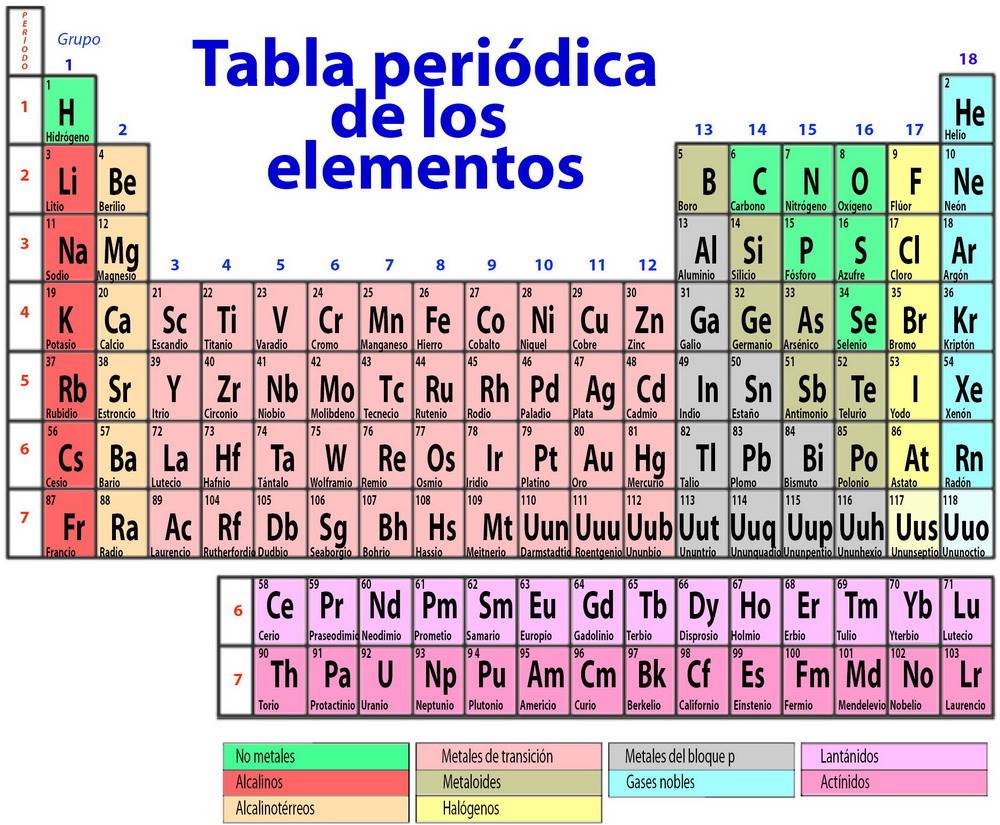
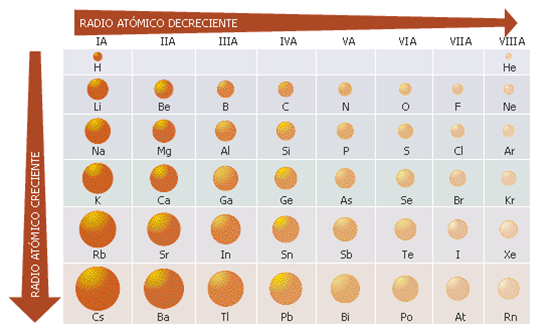
Los elem. se sitúan en orden creciente de su nº atómico. Hay 7 filas (→ periodos) y 18 columnas (→ grupos).
Se sitúan en la misma columna aquellos elem. con prop. semejantes.
En cada periodo se colocan los elem. que tienen el mismo nº de niveles o capas de E. Es decir, el nº de periodo de un elem. nos indica el nº de niveles que posee su átomo. Nombre de los periodos: 1, 2,..., 7.
Los periodos 6 y 7 incluyen a los lantánidos y actínidos, resp., que se colocan fuera de la tabla para evitar filas demasiado largas.
Ejemplo: ver el periodo 3 y el grupo 14.
 |
| METALES |
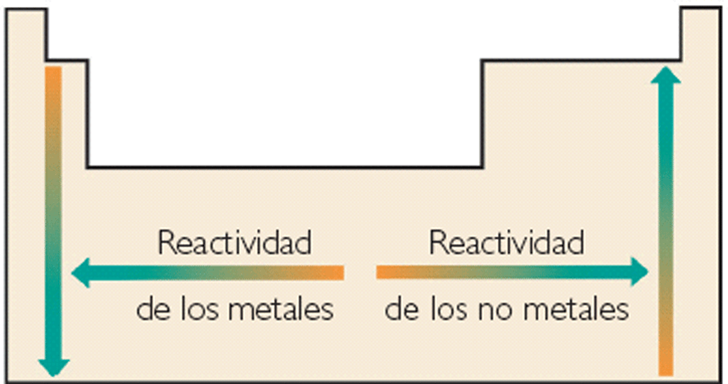
| Ocupan las zonas izda. y central. El cáracter metálico es mayor cuanto más a la izda. en un periodo y más abajo en un grupo. |
| PROPIEDADES DE LOS METALES |
| Son sólidos a la T amb. (excepto el Hg) y muy densos (ya que los núcleos están muy apretados). |
| Tienen alta densidad y tenacidad (→ resistencia a la rotura o la deformación). |
| Tienen elevadas T de fusión y ebullición. |
| Son buenos conductores del calor y la electricidad. |
| No son solubles, salvo en ácidos. |
| Son dúctiles (→ que se pueden deformar en hilos) y maleables (→ que se pueden deformar en láminas), y relativamente duros. |
| En gen., ceden e- y forman cationes. |
| Poseen brillo metálico característico y color blanco grisáceo (excepto el Au → amarillo, y el Cu → rojizo). |
| NO METALES |
| Ocupan las zonas de los grupos 13 al 18. El cáracter no metálico es mayor cuanto más a la dcha. en un periodo y más arriba en un grupo. Aunque los no metales sólo son aprox. 1/5 del total de elem., los compuestos que forman son muy numerosos, ya que se unen a los metales y tb. entre sí. Por ej., el O nos da muchos óxidos metálicos, y el C, al unirse con el H, O, N,..., dan lugar a millones de comp. orgánicos. |
| PROPIEDADES DE LOS NO METALES |
| Pueden ser sólidos, líquidos o gases a la T amb. |
| Tienen baja densidad y tenacidad. |
| Tienen T de fusión y ebullición muy variadas. |
| Son malos conductores del calor y la electricidad. |
| En gen., captan e- y forman aniones. |
| Reaccionan entre sí y con los metales. |
| No poseen brillo. |
 |
| SEMIMETALES |
| Colocados entre los metales y los no metales. Se comportan unas veces como metales y otras como no metales. |
Grupo 1 → Metales alcalinos (→ los de mayor carácter metálico).
Prop.: blandos; reaccionan con facilidad con el H, O, agua,...
Grupo 2 → Metales alcalino-térreos.
Grupo 17 (= 7b) → Halógenos (→ los de mayor carácter no metálico).
Prop.: su estado físico a T amb. y 1 atm. es muy variado; reaccionan con facilidad con los metales.
Grupo 18 (= 0) → Gases nobles (→ no son de reactivos).
| PROPIEDADES DE LOS ELEMENTOS QUÍMICOS |
| (ver fig.) |
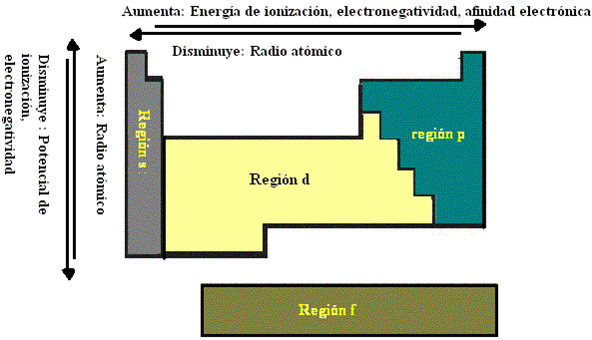 |
Las prop. de los elem. químicos son una función periódica de su nº atómico (ver fig.).
a) Masa ponderada de un elemento químico
Ejemplo:
Completa la tabla siguiente, consultando en la Tabla Periódica los datos que necesites:
| Sustancia | Masa Molecular |
Composición centesimal |
|||
|
NH3 |
|||||
|
SO3 |
|||||
|
KNO3 |
|||||
|
Cu2SO4 |
|||||
RTA.:
| Sustancia | Masa Molecular |
Composición centesimal |
|||
|
NH3 |
17 | %N = 82,35 | %H= 17,65 | ||
|
SO3 |
79,97 | %S= 40,01 | %O= 59,99 | ||
|
KNO3 |
100,97 | %K= 38,62 | %N= 13,86 | %O= 47,52 | |
|
Cu2SO4 |
223,04 | %Cu= 56,97 | %S= 14,34 | %O= 28,69 | |
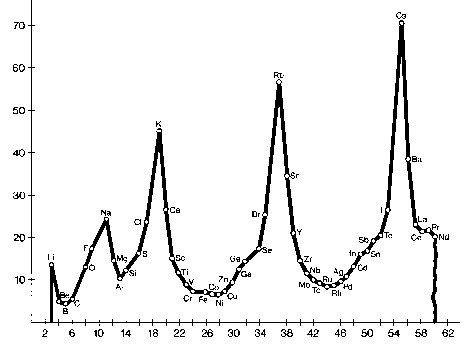
b) Volumen atómico de un elemento = (su masa atómica) / (su densidad)
Para cada periodo, el primer elem. tiene un V atómico más elevado. Este V, salvo unas pocas excepciones, va disminuyendo hasta llegar a los elem. centrales, para después aumentar nuevam. hasta alcanzar un cota máx. al llegar al metal alcalino del periodo sig.
 |
Por otra parte, el V atómico de los dif. elem. de un mismo grupo va creciendo a medida que aumenta su nº atómico.
 |
c) Energía de ionización de un elemento → es la que se necesita para separar de su átomo un e- de la última capa.
Para cada periodo, el primer elem. tiene la E de ionización más baja. Esta E, salvo unas pocas excepciones, va aumentando hasta llegar al gas noble, para el que alcanza el máx. valor.
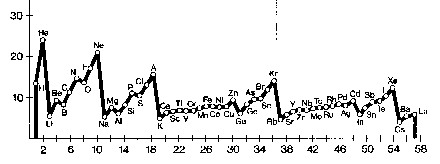 |
Por otra parte, la E de ionización de los dif. elem. de un mismo grupo va decreciendo ligeram. a medida que aumenta su nº atómico.
Los e- de la última capa se encuentran más alejados del núcleo → la F de atracción electrostática que se ejerce sobre ellos es menor → se necesita una menor E de ionización para hacer saltar al e del átomo. Por esto, la E de ionización depende de la distancia a que se encuentre del núcleo el e que deseamos "arrancar": cuanto más lejos se encuentre el e, más fácil será arrancarlo.
c) Carácter metálico de un elemento → viene determinado por su mayor facilidad para desprender e-, esto es, por su menor E de ionización.
| La E de ionización aumenta gradualm. desde la 1ª columna (primer e- arrancado) hasta la 8ª (8º e- arrancado), pero después, para el 9º e-, se produce un salto brusco, la E de ionización es mucho mayor de lo esperado. La única explicación es que ha disminuido de golpe la distancia en el 9º e- y el núcleo. Ello indica que los e- están colocados en dos capas: 8 e- en una capa más ext. y 2- en la más int. |  |
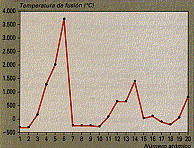
d) Estas tres gráficas: T de fusión, T de ebucillión y densidad, respectivamente, para los 20 primeros elem., son muy parecidas, repitiéndose los máimos en las tres cada 8 elementos.
 |
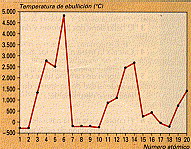 |
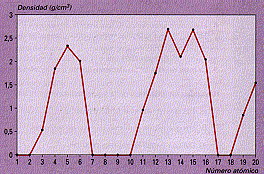 |
Ejercicio:
Indica de qué elemento se trata (la respuesta está en negrilla):
|
Elemento de mayor radio atómico |
Ca, Mg, Sr |
|
Elemento de mayor energía de ionización |
P, S, Cl |
|
Elemento de menor radio atómico |
Si, P, S |
|
Elemento de menor energía de ionización |
N, P, As |
|
Elemento con cuatro electrones de valencia |
Sb, Si , Cl |
|
Elemento del grupo de los anfígenos |
F, K, S |
|
Elemento con carácter metálico |
P, Sn , I |
|
Elemento con carácter no metálico |
B , Sr, Al |
| |
| ELECTRONES DE VALENCIA. EL ENLACE QUÍMICO |
están distribuidos en distintos niveles energéticos dentro de la corteza. Los que ocupan el nivel ext. (→ capa de valencia) son los electrones de valencia. Estos e- son los responsables de las interacciones de unos átomos con otros, y, por lo tanto, de sus prop. químicas. Las prop. químicas de los elementos dependen de los e- de valencia.
Todos los elementos de un grupo tienen el mismo nº de e- de valencia y, por lo tanto, prop. químicas parecidas.
Los átomos se unen porque interaccionan sus e- de valencia.
Los gases nobles tienen 8 e- en su capa de valencia (excepto el He); esta la causa de su estabilidad y poco reactividad química.
Los elem. tratan de completar con 8 e- su capa de valencia para conseguir la estabilidad que tienen los gases nobles.
Los átomos se unen de forma que la E final del cj. sea menor que la que tenían antes de unirse. La dif. entre las energías de los átomos antes y después del enlace se llama energía de enlace.
Enlace químico → unión de átomos de modo que la estructura resultante sea más estable (con menos E) que los átomos separados.
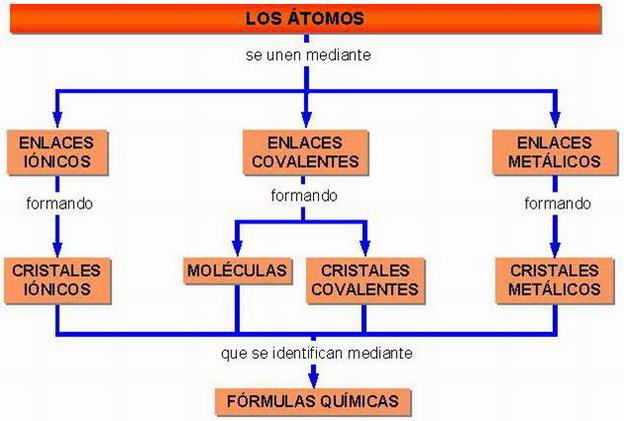 |
Las moléculas resultantes de los enlaces químicos pueden ser de elem. o de compuestos. En gen., las moléculas de los gases son diatómicas; sólo los gases nobles y los metales en estado de vapor tienen moléculas monoatómicas. Las moléculas de los compuestos tienen siempre átomos de no metales.
| Ir a ENLACES QUÍMICOS. |