| ELEMENTOS Y COMPUESTOS. TEORÍA CINÉTICO MOLECULAR |
|---|
| TEORÍA ATÓMICO- MOLECULAR |
| (p. XIX; Dalton, Avogadro y Proust) |
- La materia está formada por pequeñas part. llamadas átomos, que no se modifican en ningún proceso ni físico ni químico.
Átomo → corpúsculo más pequeño en que puede descomponerse una sust. mediante procedimientos químicos.
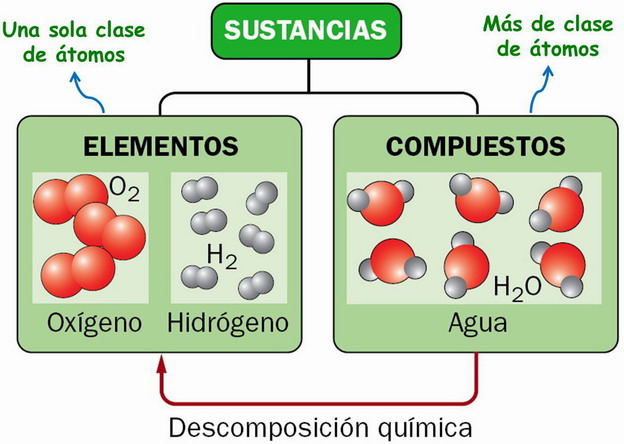
- Elemento → sust. pura que tiene todos su átomos iguales (y distintos de los átomos de otros elementos).
- Compuesto → sust. pura que se forma por la unión de átomos de elementos distintos.
 |
En los cambios químicos, los átomos cambian de lugar, pasando de forman una part. a formar otras distintas.
En los procesos físicos, los átomos se mantienen siempre en las mismas part., y son éstas las que cambiar su estado de agregación o se mezclan con otras.
Molécula → part. más pequeña en que puede descomponerse una sust. mediante procedimientos físicos. Es la parte más pequeña que puede obtenerse de un cuerpo de modo que conserve las prop. de la sust. que lo forma.
Se representan mediante modelos y fórmulas.
| MODELOS ATÓMICOS |
| (ver historia de los modelos) |
Los griegos teníana dos teorías para describir la nat. de la mat.:
- La materia es continua.
- La mat. es discontinua; llamaron átomo (= indivisible) a la part. que resultaba de la última div. de la mat. (Demócrito → los átomos son "aire, piedra, fuego y agua".).
| • (a) MODELO ATÓMICO DE DALTON (XIX) Supone que la mat. está formada por átomos, que consideraba part. neutras e indivisibles. Este modelo explica las leyes ponderales de conservación de la masa y de las proporciones, pero no explica los fenómenos eléctricos. • (b) MODELO ATÓMICO DE THOMSON (1898) (modelo estático) Fundamentos: - La mat. es eléctricam. neutra, por lo que, junto a los e-, tienen que haber alguna sust. cargada positivam. - Los e- pueden ser separados del átomo, lo que no ocurre con la carga +. Thomson imaginó el átomo como una masa fluida cargada positivam., en cuyo seno se hallaban distribuidos los e- de tal forma que el campo eléctrico en el ext. del átomo era nulo. |
 |
• (c) MODELO ATÓMICO DE RUTHERFORD (1871-1937) A raíz del descubrimiento de la radiactividad, Rutherford hizo su famoso experimento (1911) del bombardeo de la lámina de oro con part. α (+), de cuyos resultados sacaron las sig. consideraciones: - El átomo posee un núcleo central compacto en el que se hallan concentradas su masa y su carga eléctrica + (protones). |
 |
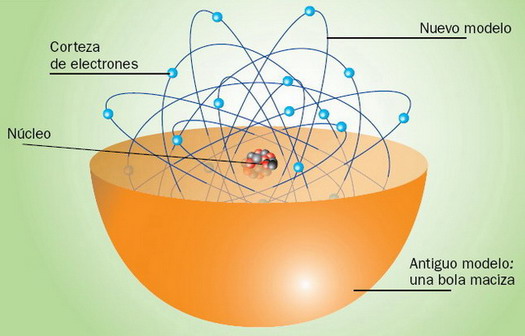 |
| - Alrededor del núcleo, y a unas distancias enormem. grandes (del orden de 10.000 veces el R del núcleo), hay una corteza de e-, que giran según órbitas circulares concéntricas (si el p tuviese 1 m, el e se encontraría a 5 km del núcleo). - El nº de e- que giran en las órbitas es igual al nº de protones que se encuentran en el núcleo, ya que el átomo en cj. es eléctricam. neutro. Después se descubrió en el núcleo una part. sin carga: el neutrón. |
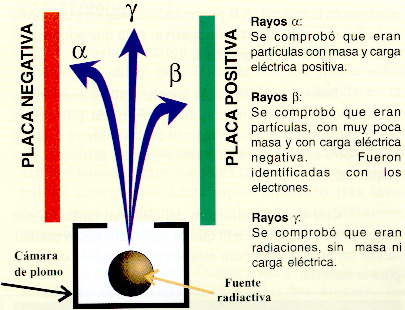
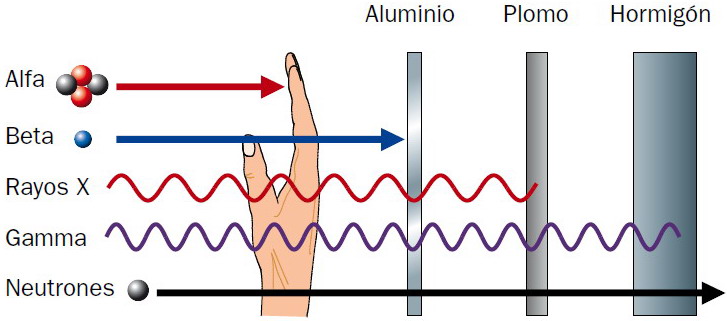
| TIPOS DE RADIACIONES (ver fig.) |
| Electromagnéticas | Rayos X Rayos γ (sin masa ni carga eléctrica) |
| Corpusculares | Rayos α → núcleos de He (2n + 2p) (con masa y carga eléctrica +) Rayos β → e- (y e+, positrones) (muy poca masa y carga eléctrica -) Radiación de protones |
 |
 |
| • (d) MODELO ATÓMICO DE BOHR (1885-1962) El modelo de Rutherford explicaba la nat. eléctrica de la mat. y la ordenación de los elem. en el sist. periódico según su carga nuclear creciente, pero no explicaba el comportamiento de los átomos en los procesos de emisión y recepción de E. |
| El modelo de Bohr supone el átomo formado por un núcleo compacto con p+ y n, y una corteza formada por capas de E dif. donde se sitúan los e-. En las capas más externas se sitúan los e- con mayor E. Los e- más ext. pueden abandonar el átomo al recibir E del ext. - Los e- giran en órbitas circulares cuyo centro es el núcleo del átomo. - Si un e- se mueve en su órbita, su E es cte. - Si un e- pasa de una órbita a otra de menor r, emite una E en forma de onda electromagnética. |
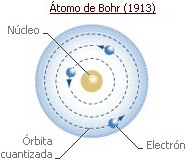 |
| Según el modelo atómico de Bohr, los e- se hallan distribuidos en el átomo ocupando diversas órbitas o capas, las cuales se denominan, por orden creciente de sus radios: K, L, M, N, O, P, Q. Cada una de estas órbitas se carac. por su dif. contenido energético. Ver modelo del He. |
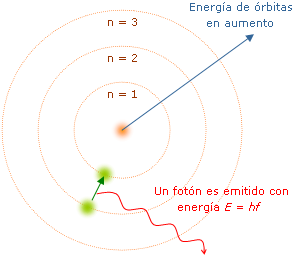
Veamos este modelo con mayor profundidad: Cuando un átomo emite E en forma de onda electromagnética, no lo hace con una frec. cualquiera, sino con unas frec. determinadas que son carac. de cada átomo. Asimismo, la cantidad de E emitida no puede tener cualquier valor, sino que ha de ser múltiplo de una cantidad mín. → cuanto de E, que distinta para cada frecuencia. Para explicar estos hechos, Bohr propuso un nuevo modelo basado en las sig. consideraciones: - Los e- giran en órbitas circulares cuyo centro es el núcleo del átomo. |
| El radio, r, de cada órbita no puede tener cualquier valor, sino que deber verificar que el producto de la cantidad del mov. del e- por la long. de su órbita debe ser múltiplo de la cte. de Plank: mv · 2 r = n · h donde: mv = cantidad de mov. del e- 2p r = long. de la órbita h = cte. de Plank - Si un e- se mueve en una órbita estacionaria, su E se mantiene cte. - Si un e- pasa de una órbita a otra de menor r, emite una E en forma de onda electromag., cuyo valor viene dado por la expresión: E = h·f donde: h = cte. de Plank f = frecuencia de la onda electromagnética |
 |
| • (d) MODELO DE LA NUBE DE CARGA (modelo actual) El modelo de Bohr no representaba de forma convincente la distribución electrónica del átomo, ya que los e- tb. podían tener órbitas elípticas (Somerfeld). Como consecuencia, dos e- de una misma capa, pueden tener dif. valor energético, debido a la distinta forma de sus trayectorias. |
| Se estableció que no es posible conocer con exactitud la posición de un e- en un instante dado, sino que únicam. se puede determinar la probabilidad de que en dicho instante se halle en una región concreta del espacio llamada orbital, que es una especie de nube eléctrica esférica alrededor del núcleo cuya carga es la del e-. Orbital es la zona donde es más alta la probabilidad (99 %) de encontrar un e-. |  |
| Según la E de los e-, sus orbitales se colocan en dif. niveles energéticos: 1, 2, 3,..., siendo el nivel 1, el más cercano al núcleo, el de menor E (ver orbitales). La mat. tiende a situarse en el estado de mín. E potencial → todos los e- de un átomo tienden a situarse en el nivel energético más bajo posible. |
| Ampliación: Cada orbital posible en un átomo puede definirse mediante cuatro parámetros números cuánticos: • Principal, n → posición del e- respecto al núcleo. Valores = niveles: 1 ˜ K, 2 ˜ L, 3 ˜ M,... • Azimutal, l → forma del orbital. Valores = subniveles: 0=s, 1=p, 2=d, 3=f,..., (n-1). • Magnético, m → orientaciones del orbital en el espacio. Valores enteros entre -1 y +1. • Spin, s → sentido del giro del e-. Dos valores: - ½ y + ½. El nº cuántico principal, n, caracteriza el V del orbital y su nivel de E (n=1 es el nivel de menor E). |
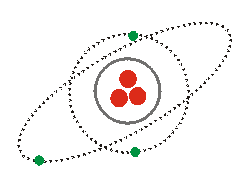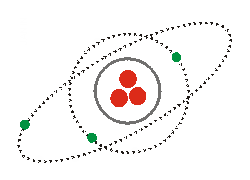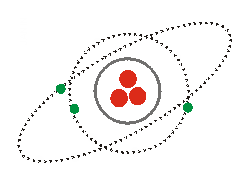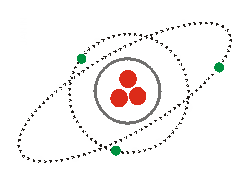 |
El nº de e- que caben en cada orbital y en cada nivel no es ilimitado (ver fig.). El Principio de exclusión de Pauli establece que en un átomo no pueden existir 2 e- que tengan iguales sus cuatro nº cuánticos. Por ello, un orbital puede albergar a lo sumo dos e-. En gen., el nivel n tiene 2n2 electrones, y cada nivel puede tener los subniveles: s → 2 e- p → 6 e- d → 10 e- f → 14 e-
Ver una forma práctica de ir llenado de e- los niveles y subniveles del átomo. |
| Ver las LEYES FUNDAMENTALES O PONDERALES DE LA QUÍMICA. |