MEZCLAS HOMOGÉNEAS: DISOLUCIONES
|
|---|
|
DISOLVENTE
|
SOLUTO
|
EJEMPOS
|
| Sólido |
Sólido |
Aleaciones: latón (Cu+Zn), bronce (Cu+Sn), acero (Fe+C), duraluminio (Al+Cu),... |
| Líquido |
Amalgama (ej.: Hg disuelto en Cu). |
| Gas |
Hidrógeno de Pt. |
| Líquido |
Sólido |
Agua del mar, agua + sal,... |
| Líquido |
Alcohol + agua,... |
| Gas |
Gaseosa (CO2 en agua), oxígeno en agua,... |
| Gas |
Sólido |
Humo,... |
| Líquido |
Niebla,... |
| Gas |
Aire,... |
• Diluidas, concentradas, saturadas (→ no admite más soluto (para una T dada, en gen.).
Una disolución saturada puede ser diluida si el soluto se disuelve poco, y puede ser concentrada si el soluto es muy soluble.
• Isotónicas, hipotónicas, hipertónicas
Tienen las mismas prop. en todos sus puntos. Cada parte homogénea que se considere en un sistema se llama fase. Las fases están separadas por superf.
Solubilidad de una sust → cantidad nec. de ésta para formar, a una T dada, una disolución saturada en cierta cantidad de disolvente.
Coeficiente de solubilidad de una sustancia → la concentración de una disolución saturada de la misma, expresada en (g de soluto) / (100 de disolvente).
Cuando una disolución saturada se enfría, o se evapora parte del disolvente, parte del soluto cristaliza.
Solubilidad de los gases:
- Al aumentar la T, la solubilidad del gas disminuye.
- A mayor P, más cantidad de gas se disuelve.
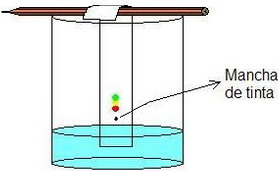
| Cromatografía → desplazar, a diferentes velocidades, los comp. de la disolución por un papel o placa absorbente mediante un disolvente, aprovechando sus distintas solubilidades. |
 |
| MEDIDA DE LA CONCENTRACIÓN DE UNA DISOLUCIÓN |
| Concentración de una disolución = (cantidad de soluto) / (cantidad determinada de disolución) |
| % en masa = (g de soluto) / (g de disolución) · 100 |
| % en V = (cm3 de soluto) / (cm3 de disolución) · 100 [1 (cm3 = 1 ml)] |
Cantidad de materia. Concepto de mol
La unidad de cantidad de materia en el S.I. se llama mol.
Un mol (molécula-gramo) de una sustancia pura → es su masa molecular expresada en g.
En un mol de una sust. pura cualquiera hay el mismo nº de moléculas = 6,023·1023 moll.= número de Avogrado, NA.
| Molaridad: M = (moles de soluto) / (L de disolución) ; moles de soluto = (g de soluto) / Pm |
Formalidad → (g de soluto) / (L de disolución)
Molalidad → m = moles de soluto / kg de disolvente
Normalidad → N = (nº de equivalentes-gramo de soluto) / (L de disolución)
nº de equivalentes-gramo = (g de soluto) / (g de 1 equivalente-gramo)
Equivalente-gramo (Eq) de un elemento → nº, en g, de que resulta de dividir su masa atómica entre su valencia (al unirse al oxígeno). Un mismo elem. pueden tener dif. Eq.
La valencia de unión del elem. A en el compuesto A2Bn es 2n, ya que hay 2 átomos de A cuya valencia es n (n es la valencia del elem. que acompaña al oxígeno).
Tenemos: Equivalente-gramo = Pm (g) / (valencia de unión). |
Hacer ejercicios.
| PROPIEDADES DE LAS DISOLUCIONES |
(a) Descenso crioscópico
Es la disminución experimentada por el punto de congelación de una disolución con resp. al del disolvente puro. El descenso crioscópico, independientem. de la nat. del soluto, es directam. proporcional a la concentración molal de la disolución: ?T = Kc· m, siendo Kc la cte. de proporcionalidad, llamada constante crioscópica molal, la cual es distinta para cada líq., teniendo para el agua un valor de Kc = -1,86 ºC·kg/mol.
(b) Aumento ebulloscópico
Es el incremento experimentado por la T de ebullición de una disolución con resp. a la del disolvente puro.
El descenso ebulloscópico, independientem. de la nat. del soluto, es directam. proporcional a la concentración molal de la disolución: ?T = Ke· m, siendo Ke la cte. de proporcionalidad, llamada constante ebulloscópica molal, la cual es distinta para cada líq., teniendo para el agua un valor de Kc = 0,512 ºC·kg/mol.
(c) Presión osmótica
Ósmosis → es el paso de disolvente a través de una membrana semiimpermeable que separa una disolución del disolvente puro, o dos disoluciones de distinta concentración. El soluto tiende a difundirse, pero como no puede pasar, lo que hace es absorber disolvente de la otra parte, con objeto de diluirse.
El fenómeno se paraliza en el momento en que la P hidrostática se iguala con la tensión de disolución. La P nec. para llegar a estar situación de equilibrio se denomina presión osmótica.
Presión osmótica, π → aquella que es preciso ejercer sobre una disolución para impedir el paso de disolvente a través de una membrana semiimpermeable. π es siempre la misma, independientem. de la nat. del soluto, dependiendo exclusivam. de su concentración.
Consideramos las part. de soluto como las moll. de un gas. Entonces, si en la ec. de los gases perfectos, π·V = n·R·T (donde cambiamos P por π) (R = 0,082), dividimos los dos miembros por V, tenemos: π = (n/V)·R·T, y como n/V es la molaridad, M, de la disolución, resulta: π = M·R·T.