| DILATACIÓN DE SÓLIDOS, LÍQUIDOS Y GASES |
|---|
Todos los cuerpos se dilatan al calentarlos, los líquidos más que los sólidos, según el tipo de material.
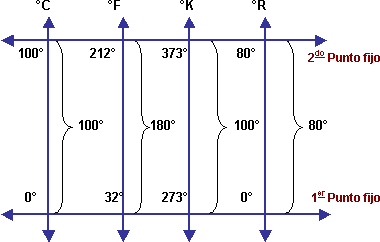
La dilatación de los líquidos se aplica para los termómetros de Hg → grado Celsius (ºC) → centésima parte entre ºC y 100 ºC.
La escala absoluta se parte del cero absoluto (cero vibración de las part.): -273 ºC → grado Kelvin (ºK) ≈ grado Celsius. X ºC = X + 273 ºK.
Aquí vemos todas las escalas y la fórmula para los correspondientes cambios de grados:
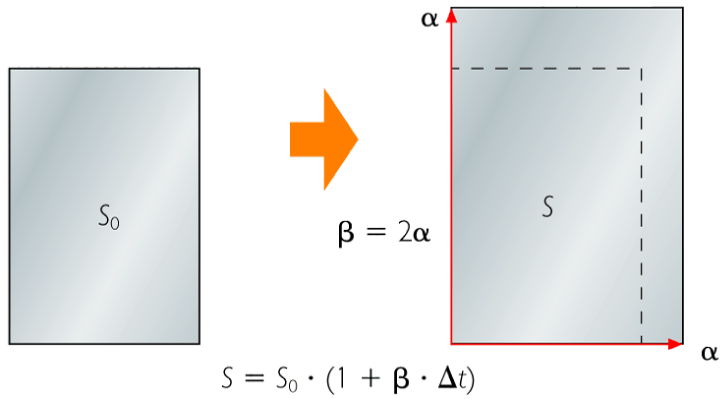
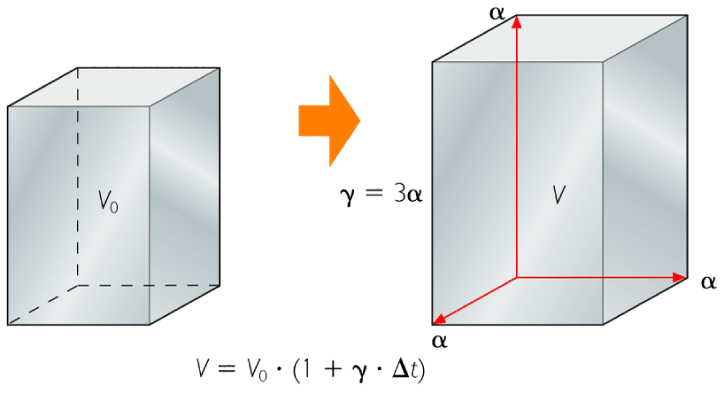
| DILATACIÓN DE LOS SÓLIDOS |
| DILATACIÓN DE LOS GASES. LEYES DE LOS GASES |
Todo gas ejerce una P debido a su tendencia a expandirse. Difusión → capacidad de los gases (y líquidos) de mezclar sus part.
Los gases se dilatan más que los líquidos y los sólidos, y, además, la dilatación es independiente del tipo de gas.
En una mezcla se gases contenidos en un recinto, presión parcial de uno de ellos es la P que ejercería si se encontrase sólo en dicho recinto.
• Ley de Dalton de las P parciales → en una mezcla de gases, la P total que se ejerce sobre las paredes del recipiente es la suma de las P que cada gas ejercería si ocupase, en las mismas cond., todo el V del recipiente.
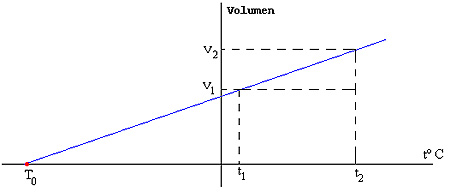
• Variación entre el V y la T, manteniendo cte. la P:
Ver la gráfica T(ºK) / V (L). Sale una recta que pasa por el origen. Luego ambas mag. son directam. proporcionales: a P cte., el V de un gas es directam. proporcional a su T: V = k·T (ley de Charles y Gay-Lussac) (o bien: V / T = cte.).
 |
• Relación entre el V y la P, manteniendo cte. la T:
Ver la gráfica P (atm) / V (L). Sale una curva que indica que, a T cte., el V de un gas es inversam. proporcional a su P: P·V = k (ley de Boyle-Mariotte) (o bien: P = k/V).
Ver también gráfica gráfica T/P (a V = cte.).
• La ecuación de los gases pefectos se obtiene uniendo ambas fórmulas:
Los gases perfectos son gases ideales, en los que el V de las part. es nulo a 0 ºK. Son parecidos a los gases reales mientras no se junten demasiado sus part. (a T muy bajas o a grandes P).
| Principio de Avogadro → V iguales de gases cualesquiera, en iguales cond. de P y T, contienen el mismo nº de moléculas: 6,023 · 1023 part. reales → el V de un mol (V molar) de cualquier gas, como tiene siempre el mismo nº de part., es siempre el mismo, y es, en cond. normales de P y T, de 22,4 L. |
Como un mol de gas, en condiciones normales, tiene 22,4 litros, tenemos que, para cualquier gas:
1 atm · 22,4 L / 273 ºK = 0,082 · atm·L/ºK = cte. = R
Si en vez de un mol, tenemos n moles, su V = 22,4 · n. Por lo tanto: 1·22,4·n / 273 = 0,082·n = cte.
Podemos escribir, pues: P·V / T = 0,082 · n. El nº 0,082 se representa por R.
La fórmula ant. (ec. fundam. de los gases perfectos) se suele escribir:
Hacer ejercicios.