| ANTÍGENOS Y ANTICUERPOS |
|---|
 |
| ANTÍGENOS |
| Suelen ser proteínas. Muchas moll. no inmunogénicas, sí lo son al unirse a proteínas. | |
| Tipos | Macromoléculas de microorg. → heteroantígenos. Moléculas de otro ind. de la misma sp. → isoantígenos. Moléculas del propio ind. → autoantígenos → autoinmunidad → graves enfermedades. |
| Los antígenenos presentan una pequeña zona → determinante antigénico = epítopos, mediante la cual se unen específicamente al anticuerpo. La zona del anticuerpo que se une específicam. a dicho epídoto se llama paratopo. El antígeno puede ser: - Univalente → si tiene un solo de epítopo → sólo puede unirse a él un anticuerpo. - Polivalente → su tiene varios lugares de unión para el mismo o dif. anticuperpos. Propiedades de los antígenos: - Inmunogenicidad → capacidad para producir una rta. inmunitaria (los antígenos son inmunógenos). - Antigenicidad → capacidad de unión de cada epítopo con su correspondiente paratopo. |
|
| Haptenos → moll. con antigenicidad pero sin inmunogenicidad. Son pequeñas moll. no inmunogénicas pero que tienen capacidad para unirse a anticuerpos específicos. Pueden adquirir prop. antigénicas si se unen a ciertas moléculas transportadoras, gen. proteínas. |
|
ANTICUERPOS = INMUNOGLOBULINAS (Ig)
Son glucoproteínas globulares (inmunoglobulinas) (Ig) producidas por los linfocitos B (células plasmáticas).
Se unen específicam. al antígeno que provocó su formación. Pueden quedar adheridos a la membrana plasmática del linfocito B donde actúan como anticuerpos de superficie receptores de antígenos, o bien son segregados al ext. como anticuerpos solubles circulantes.
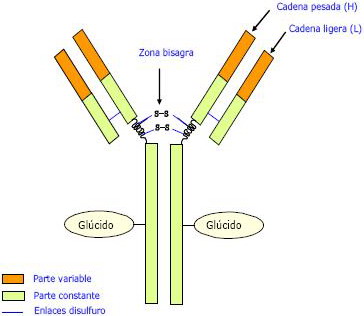 |
| ESTRUCTURA DE LOS ANTICUERPOS |
| Estructura básica en forma de Y formada por cuatro cadenas polipéptidicas o monómeros: - 2 cadenas pesadas (H) iguales, con 4 dominios: uno variable (VH) en el extremo N-terminal y tres constantes (CH) en el extremo C-terminal. - 2 cadenas ligeras (L) iguales, con 2 dominios: uno variable (VL) en el extremo N-terminal y otro constante (CH) en el extremo C-terminal. Las cadenas H y L están unidas por puentes disulfuro. La moll. adopta forma de Y → el tallo son parte de las 2 H con los radicales ácido (-COOH) terminales, y dos brazos formados por el resto de las H y las dos L, todas ellas con los radicales amino (-NH2) terminales. En la base de las H hay una zona bisagra (→ aa), por donde los brazos pueden moverse → facilitan la unión a antígenos con dif. determinantes antigénicos. • La región variable (con aa dif. en cada anticuerpo) está formada por los dominios VL y VH de las cadenas ligera y pesada, resp. (extremos aminados de H y L), los cuales conforman el sitio de unión al antígeno o paratopo. El cj. de determinantes singulares o idiotopos de los dominios variables constituyen el idiotipo del anticuerpo. La región variable es la que reconoce al antígeno y se unirá a él. Al haber tantos tipos de antígenos, debe haber otros tantos tipos de anticuerpos que se distinguirán por su región variable. Es por esto que esta región debe de tener una gran posibilidad de variación. Al tener en ambos extremos regiones variables, la moll. del anticuerpo es bivalente (valencia 2): puede unirse a dos antígenos dif. • La región constante está formada por los dominios CL y CH de las cadenas ligera y pesada, resp. El cj. de determinantes de los dominios CH caracterizan el tipo de inmunoglobulina (Ig) y constituyen el isotipo del anticuerpo. La región constante tiene una función estructural; de ella depende, en cierto modo, la localización del anticuerpo. Así, según su región constante, unos van a localizarse en la saliva, otros pueden pasar la placenta, etc. La región constante tb. desencadena la respuesta celular. Los anticuerpos se unen a los microorg. por su parte variable, lo que hace cambiar la región cte., y este cambio es detectado por los macrófagos que fagocitarán aquello que lleve anticuerpos pegados. Así, los anticuerpos libres no desencadenarán la respuesta celular. |
| FUNCIONES DE LOS ANTICUERPOS |
| - Neutralizar microorg. y sus toxinas. - Aglutinar bacterias y virus, formándose grandes complejos de aglutinación que, en ocasiones, pueden precipitar. Estos complejos de aglutinación son reconocidos por el sistema de complemento, los macrófagos o las células NK, provocando su destrucción. - Matar bacterias mediante la activación de las proteínas de complemento del suero. - Estimular el proceso de opsonización → el recubrimiento de los gérmenes patógenos por anticuerpos para facilitar su fagocitosis. - Favorecer fenómenos de citoxicidad celular. |