| ENZIMAS ALOSTÉRICAS. ALOSTERISMO |
|---|
Son las que son reguladas por el sustrato y el producto.
El ligando o efector se une específicamente a la enzima alostérica en el centro regulador de un protómero, activándola o inhibiéndola al provocar un cambio conformacional (→ transición alostérica) que se transmite al resto de los protómeros (→ transmisión alostérica) (cooperativismo).
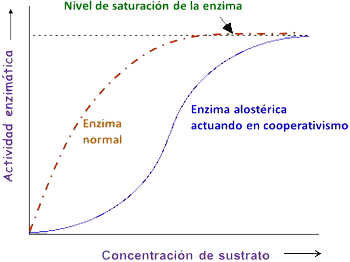
La enzima pasa de una forma inactiva a otra activa o viceversa. Por ello, la gráfica velocidad de reacción / concentración de sustrato no es la hiperbólica de la enzima normal, sino que es una curva sigmoidal o en S. |
 |
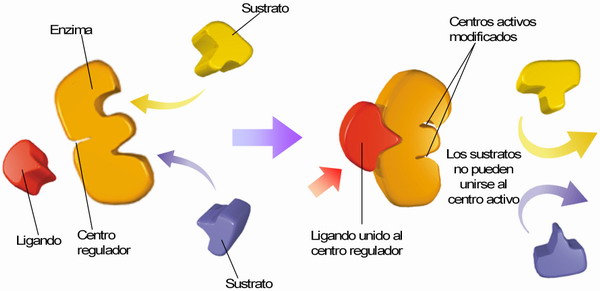 |
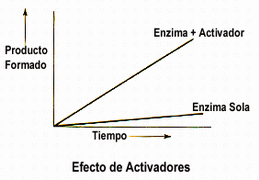
Hay dos tipos de ligandos → activadores e inhibidores:
 |
 |
• El alosterismo permite dos tipos de autoregulación de la actividad enzimática:
- Por retroinhibición o inhibición feed back En enzimas cuya conformación inicial es activa. El producto final suele actuar como ligando inhibidor, inhibiendo la unión de moléculas de sustrato a la enzima. - Por inducción enzimática En enzimas cuya conformación inicial es inactiva. Un sustrato inicial suele ser el ligando activador que provoca la transición alostérica a la forma activa → la unión de una molécula de sustrato a la enzima favorece la unión de más moléculas de sustrato. |
 |
• Formas de regular de las vías metabólicas:
- Por retroinhibición o inhibición feed back de la actividad enzimática. La enzima reguladora suele ser la primera del sistema multienzimático.
- Aumentando o disminuyendo la síntesis de dicha enzima a partir del gen que la codifica. Los principales inductores de la síntesis enzimática son las hormonas.