| LA ACTIVIDAD ENZIMÁTICA |
|---|
♣ (i) Las enzimas tienen una o varias zonas (centro activo o locus →) de las que depende su función. El sustrato o metabolito a transformar (→ ligando) se une a la enzima (adsorción) en el centro activo, lo cual implica un reconocimiento estérico (→ conformación espacial mutua complementaria). El ligando y el centro activo interaccionan mediante fuerzas químicas débiles (fuerzas de Van der Waals, puentes de hidrógeno,...). Estas interacciones se deben a que ciertos radicales de los aa de la proteína, que están en el centro activo, tienen afinidad química por determinados grupos funcionales presentes en el ligando.
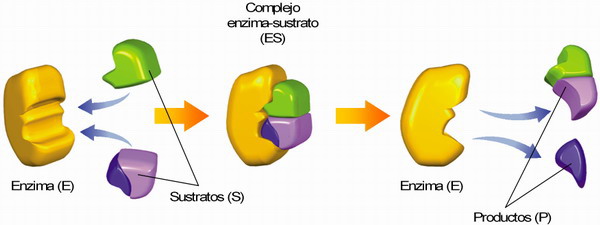 |
Al unirse el sustrato a la enzima se forman un complejo intermedio o complejo enzima-sustrato:
E + S → ES → E + P
Si son dos los sustratos: E + S1 + S2 → ES1S2 → EP1P2 → E + P1 + P2
 |
Un caso especial es el mecanismo "ping-pong".
Algunas veces la unión proteína-ligando es irreversible, como ocurre con las reacciones antígeno-anticuerpo. Otras veces es reversible.
El centro activo tiene tres tipos de aminoácidos:
- Estructurales
- De fijación
- Catalizadores
Los aa cuyos restos constituyen el centro activo pueden estar muy distantes unos de otros en la secuencia primaria de la proteína, pero que debido a los pliegues y repliegues de la estructura terciaria, quedan localizados, espacialmente, muy próximos unos de otros, formando una especie de hueco donde encajará el ligando.
El resto de los aa de la enzima tienen como misión mantener la forma y la estructura que se precisa para que el centro activo se encuentre en la posición correcta.
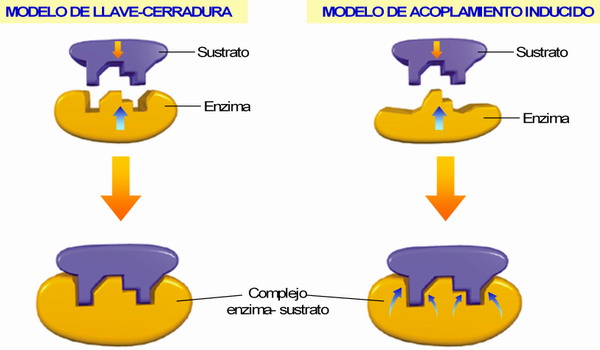
♣ (ii) La complementariedad de la unión de la enzima y el sustrato ( su alta especificidad→), se explica mediante dos modelos:
a) Modelo de llave (sustrato) - cerradura (enzima) (Fischer, 1890).
b) Modelo de acoplamiento inducido o del guante (enzima) que se adapta a la mano (sustrato). La unión del propio sustrato induce un cambio conformacional en el sitio activo que provoca el acoplamiento perfecto.
 |
La especicifidad puede ser:
- Absoluta
- De grupo (de moléculas)
- De clase (de enlace)
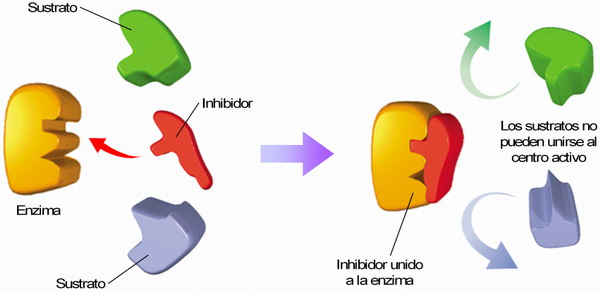
♣ (iii) Inhibición de la actividad enzimática
◊ Inhibidores irreversibles = venenos
◊ Inhibidores reversibles (→ se unen de forma temporal a la enzima).
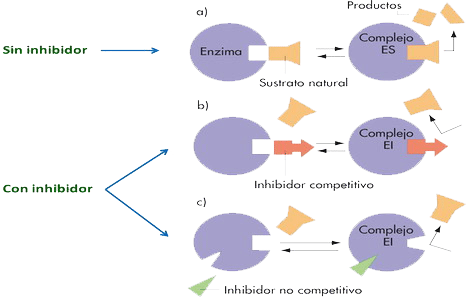 |
Tipos de inhibidores reversibles:
- Competitivos → tienen una corformación similar a la del sustrato → compiten con ésta para unirse al centro activo.
- No competitivos.
Ver inhibición por retroalimentacoión o feed-back.
♣ (iV) Cinética de la actividad enzimática
| La velocidad de reacción aumenta linealmente con la [S] (concentración del sustrato) hasta alcanzar un máx. en el que se produce la saturación de la enzima (curva hiperbólica). Ahora la velocidad sólo depende de la rapidez con que la enzima sea capaz de procesar el sustrato. Turnover = nº de recambio = constante catalítica → nº máx. de moléculas de sustrato que puede transformar una molécula de enzima en la unidad de tiempo. Equivale a la actividad de la enzima cuando la velocidad de reacción es máx. |
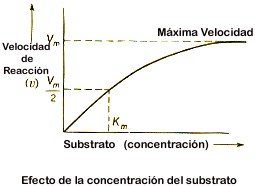 |
Constante de Michaelis (KM) → concentración de sustrato a la que la velocidad de reacción es la mitad de la velocidad máx. Hace referencia a la afinidad de la enzima por el sustrato (eficacia catalítica): si KM es pequeño, la enzima tiene gran afinidad por el sustrato, ya que la mitad de la velocidad máx. se alcanza con concentraciones bajas de sustrato.
| Ecuación para calcular la velocidad de reacción enzimática: | 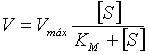 |