| ENZIMAS |
|---|
Son biocatalizadores específicos autógenos (→ elaborados por el propio ser vivo, ya que son proteínas). El papel fisiológico de los biocatalizadores no depende de la cantidad que haya, sino de su gran actividad química.
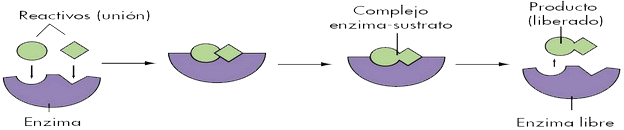 |
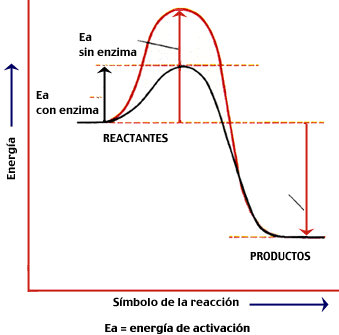
| Función → disminuir la energía de activación de las reacciones en que intervienen, aumentando su velocidad. No cambian el signo ni la cuantía de la variación de la E libre, sólo aceleran procesos espontáneos. Tampoco modifican el equilibrio de la reacción. Al finalizar la reacción, quedan libres, no se consumen. El sustrato (→ metabolito que se van a transformar) se une a la enzima en el centro activo, lo cual implica un reconocimiento estérico del sustrato. Por ello, las enzimas son específicas para cada sustrato y para cada reacción química (y su nº es incalculable). |
 |
En general, las enzimas son reversibles, actúan en los dos sentidos de la reacción, según la abundancia en el medio de cada término de la reacción (según la cte. de equilibrio). A veces no se cumple, ya que los productos resultantes pueden ser utilizados en otras reacciones enzimáticas encadenadas.
| FACTORES QUE AFECTAN A LA ACTIVIDAD ENZIMÁTICA (aparte de [S]) |
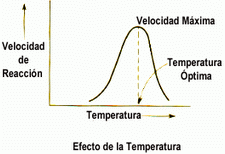
Cada enzima actúan a una T y a un pH óptimos.
Las variaciones de T inducen cambios conformacionales en la estructura de las enzimas, alterando sus centros activos y, por lo tanto, su act. biológica. Las enzimas suelen actuar a la T de los seres vivos, inactivándose a T>50-60 ºC.
 |
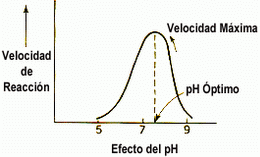 |
Las variaciones de pH provocan un cambio en las cargas eléctricas superficiales de las enzimas, alterándose su estructura y su act.
| TIPOS DE ENZIMAS. COFACTORES ENZIMÁTICOS |
| Estrictamente proteicas | ||||
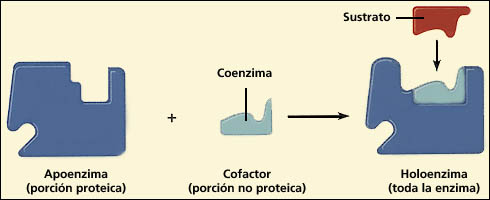
Proteínas conjugadas = holoenzimas |
Apoenzima (parte proteica) | |||
| Cofactor (parte no proteica) |
Inorgánicos → cationes metálicos: Mg2+, Fe2+ Zn2+, Ca 2+, K+, ... | |||
| Biomoléculas | Coenzimas | Unión (con el apoenzima) débil y temporal. Son transportadores de grupos químicos. |
||
| De oxidación reducción: NAD+, NADP+, FAD+,... |
||||
| De transferencia: ATP, acetil coenzima A (CoA-SH), vit.,... |
||||
| Grupos prostéticos: unión covalente fuerte y permanente | ||||
 |
| CLASIFICACIÓN DE LAS ENZIMAS |
| TIPO | REACCÓN QUE CATALIZAN | |
| Hidrolasas | Catalizan reacciones de hidrólisis con intervención del agua. | |
| Hidrólisis de enlaces éster | Lipasas Fosfatasas,... |
|
| Hidrólisis enlaces glucosídicos | Sacarasa Amilasa,... |
|
| Hidrólisis de enlaces peptídicos | Tripsina Pepsina,... |
|
| Liasas | Catalizan la liberación de grupos funcionales diversos (-NH2, CO2, H2O,...) en moléculas que poseen un doble enlace en su estructura. | |
| Transferasas = quinasas | Catalizan la trasferencia de radicales o grupos funcionales de unas moléculas a otras. | |
| Isomerasas | Catalizan reacciones de isomerizacion (→ transformación de moléculas en sus isómeros). | |
| Oxidorreductasas | Catalizan reacciones de oxido-reducción de sustratos con transferencia de H, O ó e-. | |
| Sintetasas = ligasas | Catalizan la síntesis de moléculas con hidrólisis de ATP. | |
| Ver la ACTIVIDAD ENZIMÁTICA Ver ENZIMAS ALOSTÉRICAS. ALOSTERISMO |