| ESTRUCTURA DE LAS PROTEÍNAS |
|---|
La conformación de una proteína es la disposición espacial que adopta la molécula proteica. Las cadenas peptídicas, en condiciones normales de pH y T, poseen solamente una conformación, y ésta es la responsable de las funciones que realizan.
♣ Primaria
Viene dada por la secuencia: orden que siguen los aa de una proteína. Esta secuencia determina el resto de los niveles y, por lo tanto, la función de la proteína. Se dispone en zig-zag. Con los 20 aa proteicos pueden formarse 20n polipéptidos (n = nº de aa).
Ej. de estructura primaria: H-Ala-Gly-Ser-Lys-Asp-Asn-Cys-Leu-Met-Ala- Ile-Trp-Gly-......-Pro-Asn-Glu-OH
Su alteración, , puede cambiar esta configuración y dar lugar a otra proteína diferente que no realizará su función original.
La conformación de una proteína y, por lo tanto, su centro activo y su función, pueden alterarse si se producen cambios en la estructura primaria (por eliminación, adición o intercambio de los aa) (tendríamos otra proteínas dif.).
Ej.: en la anemia falciforme, el 61 aminoácido de una de las cadenas proteicas que forman la hemoglobina, el glutámico, ha sido sustituído por valina. Como consecuencia la hemoglobina pierde su funcionalidad y no puede transportar convenientemente el oxígeno y los eritrocitos adquieren forma de hoz.
La desnaturalización irreversible destruye el centro activo y la proteína no puede ya realizar su función.
♣ Secundaria
Las características de los enlaces peptídicos imponen determinadas restricciones que obligan a que las proteínas adopten una determinada estructura secundaria.
Ésta puede ser en:
- hélice α
- hélice de colágeno
- conformación ß = lámina plegada
Es de destacar que las tres son configuraciones en hélice, diferenciandose en el número de aa por vuelta (n) y en el diámetro de la hélice. En la hélice α, n=4; en la hélice de colágeno, n=3 y en la conformación ß, n=2.
(a) Estructura en hélice α
Se trata de la forma más simple y común. La molécula adopta una disposición helicoidal; los restos (R) de los aa se sitúan hacia el exterior de la hélice y cada 3,6 residuos aa (0,54 nm) ésta da una vuelta completa (ver fig.).
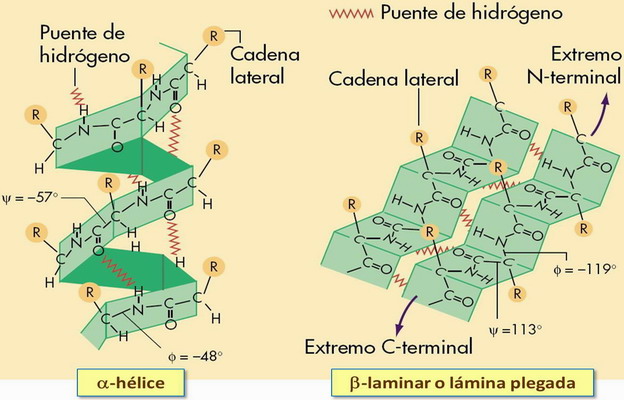 |
Este tipo de organización es muy estable, porque permite la formación de puentes de H intracatenarios entre el grupo C=O de un aa y el grupo N-H del cuarto aa situado por debajo de él en la hélice.
(b) Hélice de colágeno
Compuesta en su mayoría por el aa prolina → las cadenas se enrollan hacia la izda. → una vuelta de hélice por cada 3 residuos aa (0,29 nm) → no existen enlaces de H intracatenarios. (ver ampliación en fig.).
(c) Conformación ß
Se origina cuando la molécula proteica, o una parte de la molécula, adopta una disposición en zig-zag.
La estabilidad se consigue mediante la disposición en paralelo de varias cadenas, que pueden o no pertenecer a proteínas dif. De esta manera pueden establecerse puentes de H intercatenarios entre grupos C=O y -N-H. Los restos van quedando alternativamente hacia arriba y hacia abajo. No obstante, si la molécula presenta próximos entre sí restos muy voluminosos o con las mismas cargas eléctricas se desestabilizará.
Las cadenas polipeptídicas se pueden unir de dos formas:
- Paralela → las cadenas se disponen en el mismo sentido N-C.
- Antiparalela → las cadenas se alternan en direcciones N-C y C-N.
Una molécula no tiene que estar constituida exclusivamente por un tipo de conformación. Lo normal es que las moléculas proteicas presenten porciones con hélices α, otras partes con conformaciones ß y partes que no tienen una conformación definida y que se llaman zonas irregulares.
♣ Terciaria
Las proteínas, en el espacio, sufren plegamientos que hacen que la molécula adopte una estructura espacial tridimensional → estructura terciaria. Los pliegues que originan la estructura terciaria se deben a ciertos aa (prolina, serina, isoleucina) que distorsionan la hélice generando una curvatura.
La estructura terciaria se estabiliza por la formación de las siguientes interacciones:
- Puentes de H entre péptidos.
- Atracciones electrostáticas.
- Atracciones hidrofóbicas y fuerzas de Van der Waals entre radicales alifáticos o aromáticos.
- Puentes disulfuro entre grupos -SH (tiol) de 2 cisteínas que reaccionan para dar cistina:
-Cis-SH + HS-Cis- → -Cis-S-S-Cis-
En la estructura terciaria, los restos se van a disponer en función de su afinidad con el medio. En medio acuoso, los restos hidrófobos se sitúan hacia el interior de la molécula mientras que los restos hidrófilos lo hacen hacia el exterior.
La estructura terciaria está constituida por dominios (50-300 aa). Éstos se unen entre sí mediante una porción proteica que sirve de bisagra. Los dominios son muy estables → pueden repetirse en proteínas dif.
Tb. hay subestructura repetitivas → motivos.
Básicamente se distingen dos tipos de estructura terciaria:
- Filamentosa o fibrosa → Las cadenas laterales R apenas influyen, por lo que son proteínas alargadas, muy resistentes e insolubles en agua.
- Globular → Tienen un plegamiento jerárquico sucesivo, hasta formar una proteína esferoidal, compacta y soluble en agua (aunque muchos autores consideran que las proteínas filamentosas son proteínas que carecen de estructura terciaria).
♣ Cuaternaria
Varias cadenas polipeptídicas (→ protómeros), iguales o dif., forman la estructura cuaternaria. Tb. se considera estructura cuaternaria la unión de una o varias proteínas a otras moléculas no proteicas para formar edificios macromoléculares complejos; esto es frecuente en proteínas con Pm > 50.000. Según el número de protómeros tendremos: dímeros, tetrámeros, pentámeros, etc.
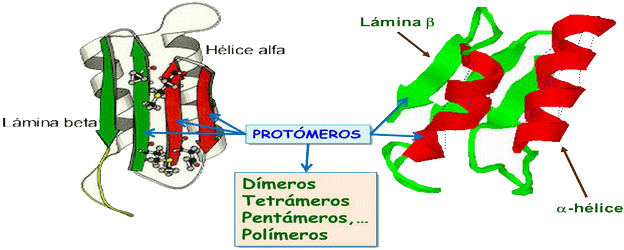 |
La asociación de las moléculas que forman una estructura cuaternaria se consigue y mantiene mediante enlaces de hidrógeno, fuerzas de Van der Waals, interacciones electrostáticas y algún que otro puente disulfuro.
Ej.:
- Hemoglobina, formada por las globinas o parte proteica (dos cadenas α y dos cadenas ß, con un total de 146 aa), más la parte no proteica o grupos hemo.
- Anticuerpos, formados también por cuatro cadenas, dos cadenas cortas y dos largas.