| PRÓTIDOS (PROTEÍNAS) (C, H, O, N, S; P, Fe, Cu, Mg,...) |
|---|
Las proteínas son polímeros de aminoácidos de elevado Pm (6000-106 da). Son las biomoléculas más abundantes en las células: más del 50% del peso seco de la célula son proteínas.
Están constituidas, fundamentalmente, por C, H, O y N y casi todas tienen también S. Algunas tienen, además, otros elementos químicos y en particular: P, Fe, Zn o Cu. El elemento más característico de las proteínas es el N. Son los compuestos nitrogenados por excelencia de los seres vivos.
Son moléculas específicas que marcan la individualidad de cada ser vivo. Además, a través de ellas se va a expresar la información genética:
DNA → RNA → Proteína
Las proteínas pueden ser:
- Holoproteínas → unión de polímeros proteicos.
- Heteroproteínas → si contienen otras moléculas orgánicas (lípidos, glúcidos,...).
| AMINOÁCIDOS |
|---|
Poseen dos funciones químicas: el grupo amino (-NH2), → carácter básico, y un grupo ácido (carboxilo) (-COOH), más una cadena lateral o grupo R (que determina sus prop.), unidos un carbono α (asimétrico).
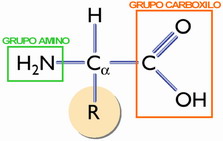 |
Todos los aa de las proteínas, salvo la prolina, responden a la fórmula general de la figura.
La cadena carbonada de los aa se numera comenzando por el grupo ácido; el C1 tiene la función ácido, y el C2, o carbono α, el grupo amino. Los aa se diferencian por en el resto (R) de la molécula.
Hay 20 aminoácidos proteicos, y otros 150 aminoácidos no proteicos libres o combinados que no forman parte de las proteínas.
Aminoácidos esenciales: fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptófano, valina, tirosina, ác. glutámico, arginina (Thr, Lys, Arg, His, Val, Leu, Ileu, Met, Phe, Trp).
En ciertos casos muy raros, por ej. en los venenos de algunas serpientes, podemos encontrar otros aa diferentes de estos 20 e incluso aa que no siguen la fórmula general.
| Con 20 aa se pueden hacer 20150 = 10195 proteínas diferentes de 150 aa cada una. Este nº es mayor que el nº de átomos del universo conocido (1080), o que el nº de seres que han vivido en la Tierra en toda su historia. |
CLASIFICACIÓN DE LOS AMINOÁCIDOS
(en función de sus carac. químicas)
| Alifáticos (R es una cadena abierta) |
Aminoácidos hidrófobos (apolares) |
| Aminoácidos cuyo resto R no es polar, esto es, no posee cargas eléctricas en R al tener en él largas cadenas hidrocarbonadas. Estos aa, si están en gran abundancia en una proteína, la hacen insoluble en agua. | |
| Aminoácidos hidrófilos (polares no ionizables) | |
| Poseen restos con cortas cadenas hidrocarbonadas en las que hay funciones polares (alcohol, tiol o amida). Contrariamente al grupo anterior, si una proteína los tiene en abundancia será soluble en agua. | |
| Aminoácidos ácidos | |
| Pertenecen a este grupo aquellos aa que tienen más de un grupo carboxilo. En las proteínas, si el pH es básico o neutro, estos grupos se encuentran cargados negativamente. | |
| Aminoácidos básicos | |
| Son aquellos aminoácidos que tienen otro u otros grupos aminos. En las proteínas, estos grupos amino, si el pH es ácido o neutro, están cargados positivamente. | |
| Aromáticos | R es una cadena cerrada (← benceno). |
| Heterocíclicos | R es una cadena cerrada compleja. |
Propiedades de los aminoácidos
• Carácter anfótero
La presencia de los grupos amino y ácido hace que sean sustancias anfóteras, pudiendo actuar ácidos o como bases, permitiendo la regulación del pH.
En disoluciones acuosas forman iones dipolares = híbridos (→ zwitterion).
 |
En un medio ácido, se comportan como una base, captado H+, y en un medio básico, se comportan como un ácido, liberando H+.
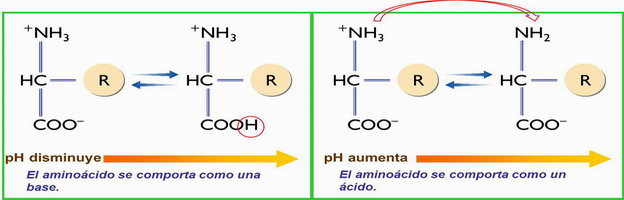 |
El pH en el que un aa forma un ión híbrido se denomina punto isoeléctrico. El ión híbrido se puede comportar como ácido o como base.
• Estereoisomería
Todos los aa, excepto la glicocola, tienen al menos el carbono α (el carbono que lleva la función amino) asimétrico → pueden presentar dos configuraciones espaciales o esteroisómeros especulares D y L, según que el -NH2 queda a la dcha. o la izda.
 |
Todos los aa proteicos son de la serie L debido a que las enzimas que los sintetizan son estereoespecíficas. No obstante, en los microorganismos (paredes bacterianas, antibióticos generados por bacterias) existen aa no proteicos pertenecientes a la serie D.
• Actividad óptica
Los aa son dextrógiros (+) o levógiros (-) según desvíen la luz hacia la decha. o hacia la izda. Ello es independiente de su isomería D o L.
| ENLACE PEPTÍTIDO |
|---|
Los aa se unen entre sí, mediante enlace peptídico, unión covalente entre el grupo carboxilo de un aa y el grupo amino de otro, con pérdida de una molécula de agua (reacción de condensación y deshidratación en la que se produce una amida y H2O). Los aa unidos por enlaces peptídicos se llaman residuos.
El resultado son péptidos (dipétidos, tripéptidos,..., oligopéptidos [4-10 residuos], polipéptidos [10-100]). La unión de dos o más polipéctidos nos da una proteína.
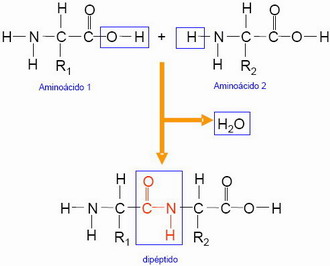 |
Los grupos amino y carboxilo de los extremos de la cadena se denominan N-terminal (amino terminal) (H-) y C-terminal (carboxilo terminal) (-OH). Los residuos se enumeran desde el aa N-terminal, de izda. a dcha. Toda cadena proteica tendrá por lo tanto una polaridad indicada mediante una H- y un -OH.
Ej.: H-Gly-Ala-Pro-Leu-Trp-Met-Ser-OH.
Características del enlace peptídico
◊ Los 4 átomos (C=0 y N-H) del grupo péptido y los 2 C se hallan en un mismo plano, manteniendo distancias y ángulos fijos. Es decir, todos los átomos que están unidos al C y al N del enlace peptídico mantienen unas distancias y ángulos característicos y están todos ellos en un mismo plano.
◊ C-N posee cierto carácter de doble enlace, lo que le impide girar libremente. Los únidos enlaces que pueden girar, y no del todo, son los formados por C-C y N-C.
Muchas sustancias naturales de gran importancia son péptidos.
Ej.:
- Ciertas hormonas, como la insulina, que regula las concentraciones de glucosa en la sangre y que está formada por dos cadenas de 21 y 30 aa unidas por puentes disulfuro.
- La encefalina (5 aa) que se produceen las neuronas cerebrales y elimina la sensación de dolor.
- Las hormonas del lóbulo posterior de la hipófisis: vasopresina y oxitocina (9 aa) que producen las contracciones del útero durante el parto.
- Algunos antibióticos como la gramicidina.
| Ver ESTRUCTURA DE LAS PROTEÍNAS Ver CLASIFICACIÓN DE LAS PROTEÍNAS Ver PROPIEDADES Y FUNCIONES DE LAS PROTEÍNAS |