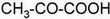♦ EL ÁTOMO DE CARBONO
Es el elemento número 6 de la tabla periódica (Z=6 y A=12). Su estructura electrónica es 1s2 2s2 2p2.
| Es el elemento más importante de los seres vivos, aunque no sea el que se encuentra en más abundancia. En la corteza terrestre es un elemento relativamente raro. Lo encontramos en la atmósfera en forma de CO2, disuelto en las aguas formando carbonatos y en la corteza constituyendo las rocas calizas (CO3Ca), el carbón y el petróleo. |
 |
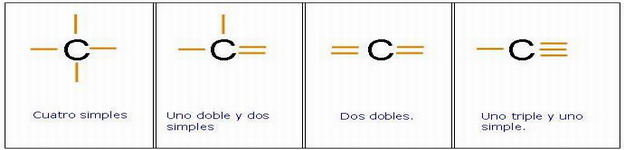
El átomo de carbono tiene 4 electrones en la última capa. Un e- del orbital 2s2 se desaparea y pasa al orbital 2pz, por lo que tiene cuatro e- desapareados en los orbitales 2s1 2px1 2py1 2pz1. Por ello, la valencia del C es 4, y sus cuatro enlaces covalentes podrán ser:
- 4 simples.
- 1 doble y 2 simples.
- 2 dobles.
- 1 simple y 1 triple.
 |
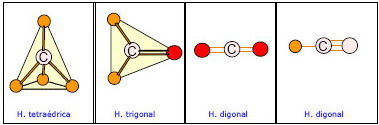
Al unirse a otros átomos mediante cuatro enlaces covalentes pueden formarse tres estructuras distintas. Estas son:
- Hibridación tetraédrica
El átomo de C está unido mediante cuatro enlaces covalentes simples a otros cuatro átomos. En este tipo de hibridación el átomo de carbono ocupa el centro de un tetraedro y los cuatro enlaces simples se dirigen hacia sus vértices.
- Hibridación trigonal
El átomo de C se une a otros tres átomos mediante dos enlaces simples y uno doble. En este caso los cuatro átomos forman un triángulo con el átomo de carbono situado en el centro. Debe tenerse en cuenta que el enlace doble es algo más corto que los enlaces simples, por lo que el triángulo no será equilátero sino isósceles.
- La hibridación digonal
Cuando el átomo de C está unido a otros dos átomos mediante un enlace simple y uno triple o mediante dos dobles.
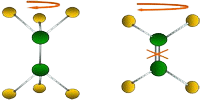
| Alrededor de un enlace simple está permirtido el giro de la molécula, pero no es así alrededor de los enlaces dobles o triples. |
 |
Tipos de cadenas carbonatadas:
Ver cadena de enlace simple, cadena con un doble enlace y otra cadena con dos dobles enlaces.
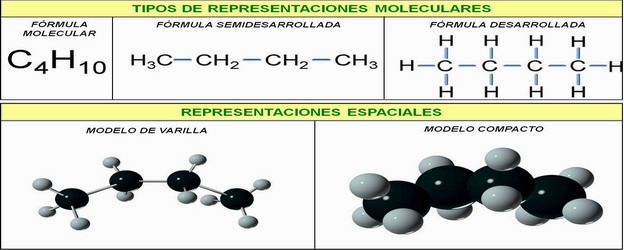
Las sustancias orgánicas pueden representarse mediante diferentes tipos de fórmulas:
a) Fórmulas desarrolladas o estructurales → se indican todos los átomos que forman la molécula y todos los enlaces covalentes los unen. Este tipo de fórmulas da la máxima información pero las moléculas complejas es laborioso representarlas.
b) Fórmulas semidesarrolladas → se indican únicamente los enlaces de la cadena carbonada. El resto de los átomos que están unidos a un determinado carbono
se agrupan según ciertas normas.
c) Fórmulas empíricas o moleculares → se indican únicamente el número de átomos de cada elemento que hay en la molécula.
Es de destacar que las fórmulas empíricas no dan una idea de la estructura de la molécula y que puede haber muchos compuestos que, siendo diferentes, tengan la misma fórmula empírica y diferente fórmula estructural.
 |
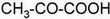 |
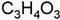 |
| Fórmulas del ácido piríuvico: desarrollada (izda.), semidesarrollada (centro) y empírica (dcha.). |
En ciertos casos, por ej., si la molécula es muy compleja, se recurre a determinadas simplificaciones.
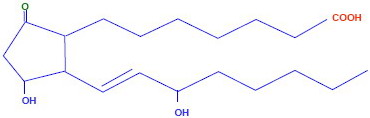
Así, las largas cadenas carbonadas de los ácidos grasos pueden representarse mediante una línea quebrada en la que no se indican ni los carbonos ni los hidrógenos pero sí se indican las funciones, los dobles enlaces u otras variaciones que posea la molécula.
También se simplifican las cadenas cíclicas, en las que a veces tampoco se indican ni los carbonos ni los hidrógenos. Ver fórmulas del colesterol: desarrollada y simplificada.
Macromolécula → grandes moléculas con masa superior a 104 da (1 da = 1 uma).
Polímero → moléculas resultantes de la unión de unidades menores → monómeros.
Monómero → unidades menores que forman los polímeros.
Ver ej. de macrómolécula: un fragmento de almidón (→ un polisacárido).
♦ ISOMERÍA
Ver un manual de formulación orgánica.