| ENLACES QUÍMICOS |
|---|
Enlace químico → Fuerza que mantiene unidos a varios átomos, iones o moléculas, formando una agrupación estable.
Los responsables del enlace químico son los e- de la última capa (→ capa de valencia), de forma que la agrupación de átomos adquiere una configuración electrónica más estable que la de cada átomo libre (los átomos tienden a adquirir la configuración electrónica de los gases nobles).
Ver tipos de enlaces químicos.
♦ ENLACE IÓNICO
Unión de iones con cargas eléctricas de signo contrario mediante F electrostáticas. La molécula formada es neutra. Ver fig. Ver formación de iones.
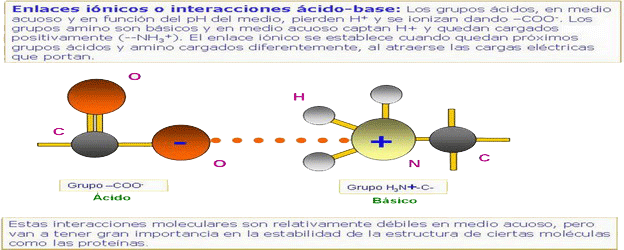
Se produce sobre todo entre un metal y un no metal (y en particular, entre moléculas que contienen grupos -COOH y -NH2). Estos grupos en agua se encuentran ionizados:
-COOH → -COO- + H+
-NH2 + H+ → -NH3+
Además de las F de atracción entre iones de signo contrario, aparecen F de repulsión entre iones del mismo signo. El resultado es que los iones se distribuyen ordenadam. en el espacio formando una red o estructura cristalina; se forman cristales.
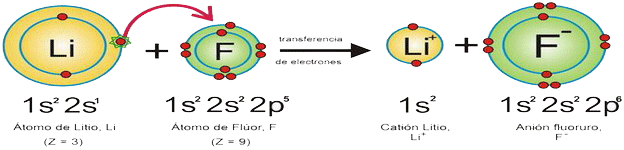 |
En consecuencia, en los comp. iónicos, no existen moléculas propiamemte dichas, sino agregados de iones que constituyen la malla espacial. Ver el cristal iónico del NaCl (sal de cocina) y el modelo de bolas.
Propiedades de los compuestos iónicos:
 |
- Son comp. sólidos a la T ambiente.
- Tienen un elevado punto de fusión y ebullición
- Son duros y quebradizos (dureza → oposición a ser rayados, debido a que esto supone la ruptura de los enlaces).
- En estado sólido no conducen la corriente eléctrica, pero sí lo hacen cuando se encuentran disueltos o fundidos.
- En gen., son solubles en agua.
♦ ENLACE COVALENTE
Unión de átomos como consecuencia de que los mismos comparten uno o varios pares de e-. Se da entre átomos no metálicos de electronegatividad similar: C-C, C-O, C-N, C-H. En la fórmula, cada par de e- compartidos se representa por medio de un guión (ver fig.).
 |
Puede ser monovalente (enlace sencillo, que permite el giro), bivalente (doble) o trivalente (triple).
Los átomos que forman las moléculas orgánicas están unidos mediante enlaces covalentes. Se trata de un enlace muy resistente cuando la molécula está en disolución acuosa, lo que es el caso de los seres vivos.
 |
El H, que contiene un solo e-, debería cederlo y convertirse en el catión H+, o tomar otro para completar su capa con 2 e-, convirtiéndose en el anión H-, para unirse a otros átomos mediante enlace iónico. Sin embargo, el H siempre se une a otros elementos. mediante enlace convalente.
Ver los enlaces covalentes de la molécula de flúor y de la molécula de HCl.
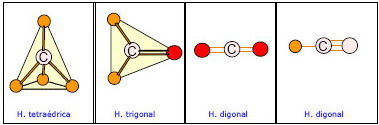 |
| Ver la disposición espacial de los enlaces en el C → hibridaciones. |
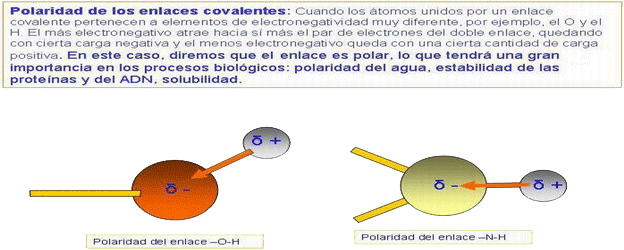
La molécula de agua es dipolar → las cargas no están distribuidas uniformem.: el O es una región - y los H una zona +.
| Cuando se estable un enlace covalente entre átomos de un mismo elemento, las cargas eléctricas se hallan distribuidas simétricamente en el cj. de la molécula → los cdg de las cargas + y - coinciden en el centro geométrico de la molécula. Pero en una unión covalente entre distintos elementos, con diferente electronegatividad, el par de e- compartidos no se halla en posición simétrica con respecto a los dos núcleos, sino que se encuentra desplazado hacia aquel que lo atrae con mayor intensidad → los cdg de las cargas + y - no coinciden, creándose un dipolo eléctrico → sist. formado por dos cargas opuestas separadas) (ej.: H2O). Momento dipolar de un dipolo eléctrico es el producto que resulta de multiplicar cualquiera de sus cargas por las distancia que las separa. |
Enlace covalente coordinado (= enlace dativo)
Cada par de e- compartido por dos átomos procede única y exclusivamete de uno de ellos (→ dador) (llamándose el otro átomo, el receptor).
 |
 |
 |
| Enlace covalente apolar. | Enlace covalente polar. |
Propiedades de los compuestos covalentes:
• Las moléculas cuyo momento dipolar es nulo, o muy pequeño, corresponden a sust. gaseosas, líquidas o sólidas con bajo punto de fusión (ya que las F de cohesión entre las moléculas son muy pequeñas).
• Las moléculas cuyo momento dipolar es aprecible corresponden a sust. líquidas o sólidas, ya que las F de cohesión intermoleculares son tanto más acusadas cuanto mayor es el momento dipolar (tb. son más elevados los puntos de fusión y elevación).
• Los cuerpos sólidos son relativamente blandos y malos conductores del Q y de la electricidad.
• Algunos sólidos covalentes carecen de unidades moleculares (ej.: el diamante). Se forma una red cristalina de átomos iguales unidos mediante enlaces covalentes en las tres direcciones. Estos enlaces son muy fuertes, por lo que estas sust. son muy duras, con un elevado punto de fusión (ver fig.).
♦ ENLACE METÁLICO Tiene lugar entre los átomos de los metales, cuyos núcleos forman un bloque compacto, por la acción de una nube electrónica que los mantiene unidos.
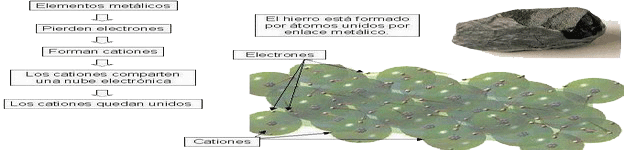 |
Los metales tienen pocos e- en su capa ext. (capa de valencia) para poder cumplir la regla del octeto, por lo que no pueden formar moléculas. Esta capa ext. tiene un contenido energético muy bajo al estar lejos del núcleo → los e- pueden desplazarse fácilmente de unos átomos a otros, formando una “nube electrónica” dotada de libertad de movimientos en toda la masa del sólido que constituye la red metálica. Los núcleos + se hallan en posiciones fijas, constituyendo la red, mientras que los e- pueden moverse libremente. Por ello, los metales son dúctiles.
 |
Tipos de redes cristalinas:
 |
♦ ENLACES INTERMOLECULARES
♣ Puentes disulfuro
Enlaces covalentes que se forman al reaccionar entre sí dos grupos -S-H para dar -S-S-. Este tipo de enlaces son extraordinariamente resistentes. Los encontraremos en las proteínas uniendo las subunidades que componen algunas moléculas proteicas.
 |
♣ Enlaces o puentes de hidrógeno
| Enlaces débiles pero que, si se dan en gran número, pueden llegar a dar una gran estabilidad a las moléculas. Se deben a la mayor o menor electronegatividad de los elementos que participan en un enlace covalente. |  |
Así, por ejemplo, en los grupos -C-O-H, el O es más electronegativo que el H y atrae hacia sí el par de electrones que forma el enlace covalente. En las proximidades del O habrá un exceso de carga negativa y, por el contrario, el H estará cargado positivamente.
 |
| Formación de un puente de H entre un grupo -O-H y un grupo H-N=. |
Lo mismo sucede con los grupos -C-N-H, u otros, en los que también se produce una diferencia de electronegatividad. Como consecuencia se generarán fuerzas eléctricas entre átomos que presentan un exceso de carga positiva (H) y otros con exceso de carga negativa (O, por ejemplo).
Estos enlaces son de gran importancia en determinados compuestos y, en particular, en las proteínas y en los ácidos nucleicos.
 |
| Puentes de H en el agua (ver fig.) |
♣ Fuerzas de Van der Waals
|
Se trata de fuerzas de carácter eléctrico debidas a pequeñas fluctuaciones en la carga de los átomos. Actúan cuando las moléculas se encuentran muy próximas unas a otras. |
 |
♣ Uniones hidrofóbicas
Ciertas sustancias insolubles en agua, cuando están en un medio acuoso van a mantenerse unidas entre sí por su repulsión al medio en el que se encuentran. Estas uniones, aunque son muy débiles, van a ser de gran importancia en el mantenimiento de los componentes lipídicos de la membranas celulares y en la configuración de muchas proteínas.
Hacer ejercicios.