| LAS SALES MINERALES |
|---|
 |
 |
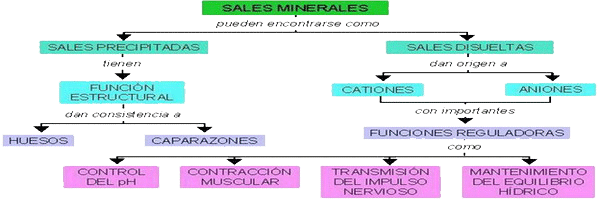
| LAS SALES MINERALES |
| En disolución | Aniones: Cl-, PO43-, CO32-, NO3-,... Cationes: Na+, Ca2+, Mg2+, Fe2+, Fe3+, K+ |
Intervienen en la regulación de las reacciones metabólicas |
| Intervienen en el funcionamiento de ciertos órganos. | ||
| Regulan la presión osmótica y el volumen celular, manteniendo el grado de salinidad de los organismos. Disoluciones: · hipertónicas → turgencia en las células · hipotónicas → plasmólisis · isotónicas |
||
| En estado sólido | Forman estructuras esqueléticas de protección o sostén: · Fosfato cálcico → Forma la matriz mineral de los huesos · Carbonato cálcico → Endurece huesos y dientes |
|
 |
| Ver las funciones iónicas con más detalle. |
 |
| LAS SALES MINERALES |
| En disolución | Aniones: Cl-, PO43-, CO32-, NO3-,... Cationes: Na+, Ca2+, Mg2+, Fe2+, Fe3+, K+ |
Intervienen en la regulación de las reacciones metabólicas (regulan la actividad enzimática), colaborando en la homeostasis. |
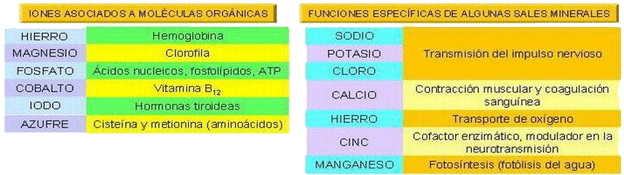
| Los cationes realizan acciones específicas: intervienen en el funcionamiento de ciertos órganos, a veces con funciones antagónicas. Ej.: corazón: Ca2+→ sístole; Na+ y K+ → diástole. |
||
| Regulan la presión osmótica y el volumen celular, manteniendo el grado de salinidad de los organismos. Disoluciones: · hipertónicas → turgencia en las células. · hipotónicas → plasmólisis. · isotónicas |
||
| Regulan el pH (equilibrio ácido-base) → tampones = disoluciones amortiguadoras | ||
| Generan potenciales eléctricos a ambos lados de una membrana (→ conducción nerviosa y contracción muscular). | ||
| En estado sólido | Forman estructuras esqueléticas de protección o sostén: ♦ Fosfato cálcico → Forma la matriz mineral de los huesos. ♦ Carbonato cálcico: - Endurece huesos y dientes. - Forma los caparazones, conchas, exoesqueletos, corales,... - Constituye los oolitos del oído interno (→ equilibrio). ♦ Silicatos: - Caparazones de radiolarios y diatomeas. - Espículas de algunas esponjas. - Estructuras de sostén de algunos vegetales. |
|
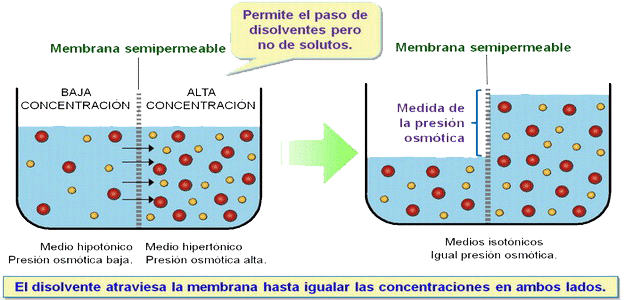
| ÓSMOSIS |
 |
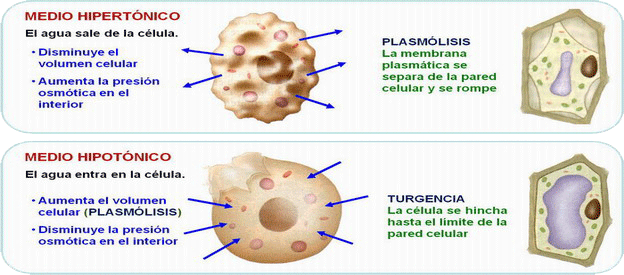 |
| Consecuencias biológicas de la ósmosis. Ver las osmorregulación en los peces. |
♣ DISOLUCIONES AMORTIGUADORAS
El pH (escala 1 a 14) de los sistemas vivos debe estar en torno a 7, habiendo un equilibrio en los H+ y los OH-. El exceso de sustancias ácidas o básicas producidas en las reacciones metabólicas, que alteran el pH del medio celular, es neutralizado por sistema amortiguador = tampón = buffers, constituido por un ácido débil y una sal de dicho ácido. El exceso de H+ es absorbido por el anión de la sal y así se forma un poco más de ácido débil, que se disocia relativam. poco. El exceso de OH- se combina con el ácido débil y hace que éste libere en la solución su H+.
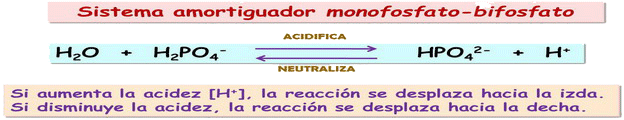
Ej., el ión bicarbonato, HCO3-, actúa como tampón en los medios orgánicos. Si el pH es ácido habrá un exceso de iones H3O+. Estos serán captados por el ión HCO3- que se transformará en H2CO3 y H2O, con lo que el pH aumentará. El H2CO3, a su vez, se descompondrá en CO2 y H2O. El proceso se desarrolla a la inversa si hay pocos iones H3O+.
El ión bicarbonato actúa como un tampón eficaz para valores de pH en las proximidades de 7, que es el pH de la sangre.
En los medios intracelulares el tampón más frecuente es el ión fosfato, H2PO4-.
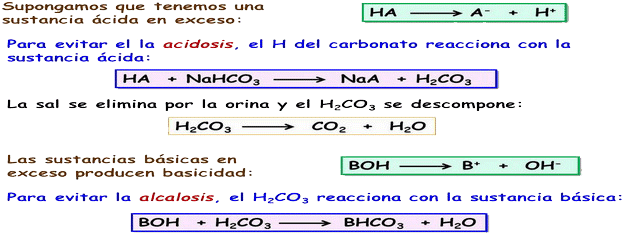
| Sistema tampón H2CO3 - NaHCO3 Las sust. ácidas en exceso producen acidez: HA → A- + H+. Para evitarlo, el hidrógeno carbonato del sist. tampón reacciona con la sust. ácida: HA + NaHCO3 → NaA + H2CO3 La sal se elimina por la orina, y el ácido carbónico se descompone: H2CO3 → CO2 + H2O Las sust. básicas en exceso producen basicidad: BOH → B+ + OH-. Para evitarlo, el ácido carbónico reacciona con la sust. básica: BOH + H2CO3 → BHCO3 + H2O |
 |
 |
 |
♣ Ver DISOLUCIONES Y DISPERSIONES COLOIDALES.
♣ SOLUBILIDAD
El agua es un buen disolvente de los compuestos iónicos. Esto es debido a que el agua es una sustancia polar. Las moléculas de agua se disponen alrededor de los iones positivos con la parte negativa de su molécula hacia ellos y en el caso de los iones negativos les enfrentan la parte positiva. No confundir solubilidad con difusion.
Ver la curva de solubilidad de diferentes iones según la temperatura.
También son solubles en agua las sustancias polares, por ejemplo: los glúcidos; normalmente, estas sustancias tienen una elevada proporción de oxígeno.
Por el contrario, aquellas sustancias orgánicas que presentan una elevada proporción de hidrógeno y pocos átomos de oxígeno son poco solubles en agua; por ejemplo: los lípidos.
 |
| Sustancias según su solubilidad. |
| Los fosfolípidos son un ejemplo de sustancias anfipáticas: |
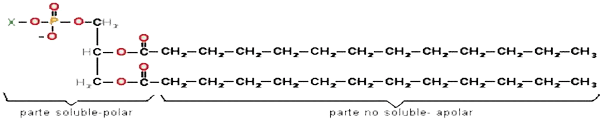 |
Algunas sustancias tienen una parte de su molécula que es soluble en agua (hidrófila) y otra parte insoluble (hidrófoba). Estas sustancias se dice que son anfipáticas; cuando están en un medio acuoso, orientan su molécula y dan lugar a la formación de micelas, monocapas (en una superf. acuosa) o bicapas (separadoras de dos medios acuosos).
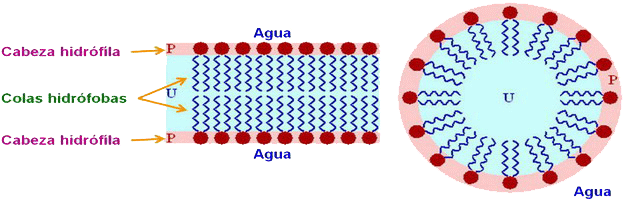 |
| Ver micelas y bicapas. |
Las grandes moléculas, como las proteínas, si son solubles en agua, forman disoluciones coloidales, las cuales pueden estar en dos estados: sol y gel. El paso de un estado a otro es reversible y diversos factores físicos y químicos (el pH, la T o una alteración en la concentración de determinados iones presentes en el medio) pueden hacer que una solución pase de un estado a otro sin necesidad de variar la concentración de soluto.