| EL AGUA |
|---|
Un 70-90 % de un ser vivo es agua. Cuanto más joven y cuanto más noble es el tejido, más agua contiene. Además, está en constante renovación.
El agua en los seres vivos se encuentra tanto intra como extracelularmente. El agua intracelular, la que está en el interior de las células, representa 2/3, aproximadamente,
del agua que contiene un ser vivo y el agua extracelular representa el tercio restante. Tb. puede ser circulante, de imbición o ligada, y exógena o endógena = metabólica.
Densidad (a 4ºC)........ 1g/cm3
Densidad (0ºC)........... 0'97g/cm3
| % de agua en animales | % de agua en vegetales | % de agua en tejidos |
| hombre, 65 medusa, 96 caracol, 80 crustáceos, 77 bacteria, 80 insecto, 72 |
setas, 91 espárrago, 93 lechuga, 94 tabaco, 92 algas, 98 líquenes, 55 zanahorias, 87 patatas, 78 garbanzos, 11 trigo, 11 |
sangre, 78 |
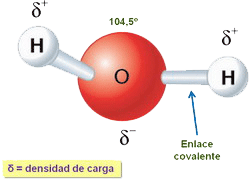
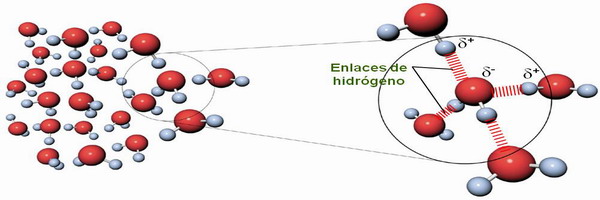
| Aunque es eléctricamente neutra, las moléculas de agua tienen carácter polar debido a un exceso de carga negativa sobre el átomo de oxígeno (ver fig. de la dcha.) (ver fig.). Debido a su polaridad, las moléculas de agua establecen enlaces de puente de H entre ellas (ver fig. de abajo). |
 |
 |
 |
| FUNCIONES DEL AGUA |
| Por su carácter dipolar, tiene tiene una elevada capacidad disolvente de sales minerales. Como consecuencia: - Actúa como vehículo de transporte de sustancias disueltas. - Facilita el intercambio entre las células y el medio. - En el agua transcurren la mayoría de las reacciones metabólicas |
| - Da volumen y turgencia a las células. - Actúa como lubricante y protección, favoreciendo el desplazamiento de órganos. |
| Capilaridad. Ello facilita, por ej., el ascenso de la savia bruta por los vasos leñosos de la planta. |
| Regula la Temperatura: - Amortigua los cambios térmicos bruscos. - Refrigera la T corporal ante el ambiente. - Distribuye el calor en el org., evitando su acumulación . |
| Actúa como reactivo químico al disociarse en H3O+ y OH-. |
| Entre 0-4 ºC tiene la máx. densidad → el hielo flota y forma una capa aislante que hace posible la vida acuática en ambientes fríos. |
| |
 |
| La molécula de agua es eléctricamente neutra pero con momento dipolar, por lo que se forman puentes de H entre sus moléculas → cohesividad lo que hace que sea líquida en un amplio intervalo de temperatura y le otorga el resto de sus prop: capilaridad, incomprensibilidad,... → La vida existe en dif. climas. | |
| PROPIEDADES FISICOQUÍMICAS | FUNCIONES BIOLÓGICAS DEL AGUA |
| Por su carácter dipolar, tiene una cte. dieléctrica elevada → elevada capacidad disolvente de: - Sales minerales (→ solvatación iónica). - Compuestos orgánicos ionizables o neutros (con grupos funcionales polares). - Con sust. anfipaticas forma dispersiones coloidales → micelas. Sistemas dispersos: - suspensión - dispersión = disolución coloidal (→ sol, gel) - disolución 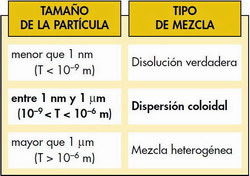 |
- Agua circulante. - Agua intersticial intercelular, a veces adherida a la sust. intercelular (agua de inhibición). - Agua intracelular. |
| - Actúa como vehículo de transporte de sustancias disueltas. - Facilita el intercambio entre las células y el medio. - En el agua transcurren la mayoría de las reacciones metabólicas |
|
| Elevada cohesión molecular → - incomprensibilidad y baja viscosidad - gran tensión superficial - elevada fuerza de adhesión,... |
- Da volumen a las células y turgencia a las plantas, y provoca deformaciones y movimientos protoplasmáticos. - Sirve como esqueleto hídrico en invertebrados. - Como lubricante (amortiguador mecánico), favoreciendo el desplazamiento de órganos, y de protección. |
| Elevada tensión superficial, debido a las fuerzas de atracción hacia el int. del líquido. | Origina una "película superficial" de resistencia que permite el desplazamiento sobre el algua de algunos org. |
| Elevada fuerza de adhesión (de las moléculas de agua a las paredes de los capilares) → capilaridad. | Facilita el ascenso de la savia bruta por los vasos leñosos del xilema. Ver cromatografía en papel. |
| Calor específico (Q=m·ce·[t1-t2]), calor latente de vaporización y conductividad altos. Ver gráfica de la curva de estado del agua. |
Regula la Temperatura: - Amortigua los cambios térmicos bruscos. - Refrigera la T corporal ante el ambiente. - Distribuye el calor en el org., evitando su acumulación . |
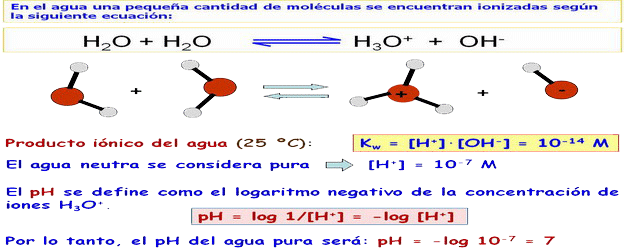
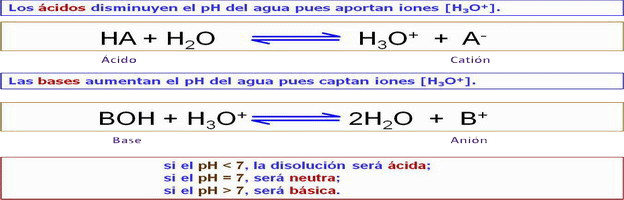
| Bajo grado de ionización o disociación en H3O+ (H+) y OH-: H2O + H2O ↔ H3O+ + OH- → actúa como reactivo químico: - En las reacciones de hidrólisis. - El agua puede ser adicionada a un doble enlace formándose una función alcohol. - El agua es imp. en la fotosíntesis por ser la sust. que repone los e- que se usan en la síntesis orgánica. Las sust.ácidas se disocian al disolverse y producen H+ que aumentan la [H3O+]. Las sust. básicas tb. se disocian produciendo OH- que se unen a los H3O+ formándose 2H2O → [H3O+] disminuye → [H+] = [H3O+] se puede tomar como una medida de su acidez o basicidad. [H3O+] = [H+] = 10-7 moles/litro de agua pura. Al ser la ionización pequeña, [H2O] = 1 (1 M). Entonces, según la ley de acción de masas: [H3O+] x [OH-] / [H2O] = 10-7 · 10-7 / 1 = k = 10-14. Es dedir, el producto iónico: [H3O+] x [OH-] = cte.= 10-14. pH = -log [H3O+] (→ 1,...,14). |
|
| Coeficiente de dilatación negativo entre 0-4 ºC → tiene la máx. densidad a los 4 ºC. | El hielo flota y forma una capa aislante que hace posible la vida acuática en ambientes fríos. Ver estructura del hielo. |
 |
 |
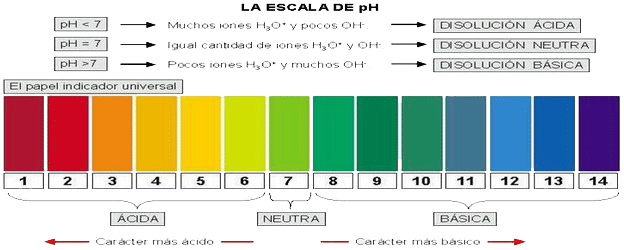 |
| Ver la escala de pH con sustancias cotidianas. |